
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )| A. | 将甲升温,可使甲和乙中各物质的体积分数达到相同 | |
| B. | x=2,且M、N中仅有一种为气态 | |
| C. | 曲线II为甲中R的物质的量一时间图象 | |
| D. | 其他条件不变时,向乙中再加入1mol M、1molN,达到新平衡时,则有1.0mol<n(R)<1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
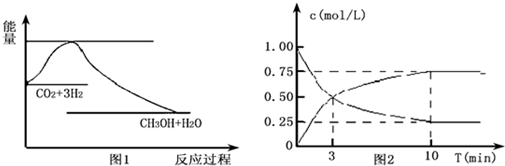
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾是常用的净水剂、具有杀菌、消毒的作用 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 考古时,利用14C测定一些文物的年代 | |
| D. | 煤的干馏和石油的分馏都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压下,相同体积的任何气体单质所含的原子数相等 | |
| B. | 1 mol某气体的体积为22.4L,该气体所处的状态一定是标准状况 | |
| C. | 在常温常压下,11.2LN2所含原子数为NA | |
| D. | 标准状况下,22.4LN2和O2混合物所含的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com