
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式____。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中P元素的化合价为___。
② 利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为__________(填化学式)。
③从分类来看,NaH2PO2属于______
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式_______Ba(H2PO2)2与H2SO4的离子方程式___________。
【答案】H3PO2![]() H2PO2-+H+ +1 H3PO4 AC 2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑ Ba2++H2PO2-+H++SO42-=H3PO2+BaSO4↓
H2PO2-+H+ +1 H3PO4 AC 2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑ Ba2++H2PO2-+H++SO42-=H3PO2+BaSO4↓
【解析】
(1)H3PO2是一元弱酸,在水溶液里部分电离生成氢离子和酸根离子;
(2)①根据化合物中化合价的代数和为0确定P元素化合价;②根据转移电子守恒判断氧化产物;③根据H3PO2是一元中强酸分析判断次磷酸钠的类型;
(3)根据反应物和生成物书写方程式。
(1)H3PO2是一元中强酸,在水溶液里部分电离生成氢离子和酸根离子,电离方程式为H3PO2H++H2PO2-,故答案为:H3PO2H++H2PO2-;
(2)①根据化合物中化合价的代数和为0确定P元素化合价,H3PO2中O元素为-2价、H元素为+1价,所以P元素为+1价,故答案为:+1;
②该反应中银离子是氧化剂、H3PO2是还原剂,氧化剂与还原剂的物质的量之比为4∶1,根据转移电子相等知,1molH3PO2失去4mol电子,所以产物中P元素为+5价,则氧化产物是H3PO4,故答案为:H3PO4;
③H3PO2是一元中强酸,则次磷酸钠(NaH2PO2)是正盐,次磷酸钠还含有钠离子,也属于钠盐,故选:AC;
(3)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,反应方程式为2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,Ba(H2PO2)2与H2SO4反应生成次磷酸和硫酸钡沉淀,反应的离子方程式为Ba2++H2PO2-+H++SO42-=H3PO2+BaSO4↓,故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑;Ba2++H2PO2-+H++SO42-=H3PO2+BaSO4↓。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】如图是一种叶绿素分子(左)和血红蛋白分子(右)的局部结构简图,下列说法不正确的是( )
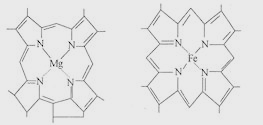
A.合成叶绿素和血红蛋白分别需要镁和铁
B.植物体缺氮会影响光合作用
C.人体缺铁会影响血红蛋白对氧的运输
D.Mg和Fe分别存在于植物和动物细胞中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药托瑞米芬的前体K的合成路线如下。

已知:
ⅰ. 
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]()
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是___________,反应类型是___________________________。
(2)D中含有的官能团:__________________。
(3)E的结构简式为__________________。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为__________________。
(5)M是J的同分异构体,符合下列条件的M的结构简式是__________________。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1 mol M最多消耗2 mol NaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是__________________。
(7)由K合成托瑞米芬的过程:
![]()
托瑞米芬具有反式结构,其结构简式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1NaOH溶液:Na+、K+、![]() 、
、![]()
B. 0.1 mol·L1FeCl2溶液:K+、Mg2+、![]() 、
、![]()
C. 0.1 mol·L1K2CO3溶液:Na+、Ba2+、Cl、OH
D. 0.1 mol·L1H2SO4溶液:K+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(L.Pauling)教授的诞辰100周年。1994年这位老人谢世后,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它能合成吗?它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜,也许有朝一日你就能解开它。不管结果如何,让我们先对这个结构作一番了解。

(1)它的分子式是__________________________________________________________。
(2)它的所有原子是否可能处于同一个平面上?________(填“可能”或“不可能”)。
(3)它是否带有电荷?________(填“是”或“否”)。
(4)该分子中sp杂化的氮原子有___个;sp2杂化的氮原子有___个;sp3杂化的氮原子有_____个。
(5)为什么人们推测它是炸药?______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备CuO。
(1)Cu2+基态核外电子排布式为____。
(2)![]() 的空间构型为____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为____(填元素符号)。
的空间构型为____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为____(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____;推测抗坏血酸在水中的溶解性:____(填“难溶于水”或“易溶于水”)。

(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①CH3CH2CH3 ②CH3CH2CH2CH3 ③CH3CH2CH2CH2CH3 ④![]()
⑤ ⑥CH3CH2CH2CH2CH2CH3
⑥CH3CH2CH2CH2CH2CH3
上述物质的沸点按由高到低的顺序排列的是( )
A. ⑥③④⑤②① B. ⑥③②①④⑤ C. ⑤④⑥③②① D. ⑥⑤④③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com