
【题目】利用化学原理可以对工厂排放的废水,废渣等进行有效检测与合理处理。某工厂对制革工业污泥中部的处理工艺流程如下:
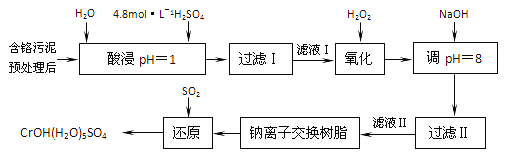
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1) 酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,则此反应中氧化剂和还原剂物质的量之比为_______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁高子浓度不超过1mol·L-1)。____(填“是”或“否”(已知Ksp[Mg(OH)2]=1.8×10-11)。
(4)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原时发生反应的离子方程式_____________。
【答案】 升高温度(加热) 搅拌 3:2 pH超过8会使部分Al(OH)3溶解生成AlO2-![]() ,最终影响Cr回收与再利用 否 3SO2+2CrO42-+12H2O
,最终影响Cr回收与再利用 否 3SO2+2CrO42-+12H2O![]() 2CrOH(H2O)5SO4↓+SO42-+2OH-
2CrOH(H2O)5SO4↓+SO42-+2OH-
【解析】(1) 酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施,可以升高温度增大物质的溶解度或加快搅拌速度,因此本题答案为:升高温度(加热) ;搅拌。
(2)H2O2将Cr3+转化为Cr2O72-,H2O2作氧化剂,Cr3+被氧化,发生的反应为:2 Cr3++3 H2O2+H2O= Cr2O72-+8H+,氧化剂和还原剂物质的量之比为3:2。
(3)①pH=8时,Fe3+、Al3+已沉淀完全,滤液II中主要阳离子有:Na+、Mg2+、Ca2+ ,pH>8时, 会使部分Al(OH)3溶解生成AlO2-,会影响Cr回收与再利用。
②当pH=8时,c(Mg2+)![]() c2(OH-)=(Ksp[Mg(OH)2]=1.8×10-11,c(Mg2+)=
c2(OH-)=(Ksp[Mg(OH)2]=1.8×10-11,c(Mg2+)=![]() =
=![]() =18mol/L, 溶液中镁高子浓度不超过1mol·L-1,因此,此时Mg2+不沉淀。
=18mol/L, 溶液中镁高子浓度不超过1mol·L-1,因此,此时Mg2+不沉淀。
(4)流程中用SO2进行还原时,Na2 CrO4被还原CrOH(H2O)5SO4,SO2被氧化为SO42-,根据原子守恒写出反应的离子方程式:3SO2+2CrO42-+12H2O![]() 2CrOH(H2O)5SO4↓+SO42-+2OH-
2CrOH(H2O)5SO4↓+SO42-+2OH-


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中二氧化碳含量的持续增加,会产生温室效应,一种处理二氧化碳的重要方法是将二氧化碳还原,![]() ,下列说法(NA代表阿伏加德罗常数)正确的是
,下列说法(NA代表阿伏加德罗常数)正确的是
A. 2.24LCO2含有双键的数目为0.2NA
B. 1molCO2和2molH2充分反应生成CH4分子数为0.5NA
C. 通常状况下,0.1molCH4中含有的电子数为NA
D. 生成18gH2O转移电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组离子中一定能大量共存的是 ( )
A. K+、H+、Cl﹣、CO32﹣ B. Fe3+、Mg2+、NO3﹣、SCN﹣
C. NO3﹣ H+、Fe2+、SO42﹣ D. Na+、OH﹣、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示(t0~t1阶段的c(B)变化未画出).乙图为t时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂.下列说法中不正确的是
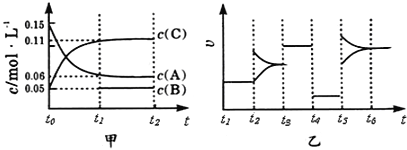
A. 若t1=15s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004molL-1s-1
B. t4~t5阶段改变的条件一定为减小压强
C. 该容器的容积为2L,B的起始物质的量为0.02mol
D. 该化学反应方程式为3A(g)B(g)+2C(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com