
 H+ + CN-, K(1)Θ =" 4.9" ×10-10
H+ + CN-, K(1)Θ =" 4.9" ×10-10 NH4+ + OH-, K(2)Θ =" 1.8" ×10-5
NH4+ + OH-, K(2)Θ =" 1.8" ×10-5  H+ + OH-, KwΘ =" 1.0" ×10-14算出NH3 + HCN
H+ + OH-, KwΘ =" 1.0" ×10-14算出NH3 + HCN  NH4+ + CN-, 反应平衡常数的K值是_________________
NH4+ + CN-, 反应平衡常数的K值是_________________ 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.H2 + O2 = 2H2O△H= -571.6KJ/mol |
| B.H2(g)+ 1/2O2(g)= H2O (l)△H= -142.9KJ/mol |
| C.H2(g)+ 1/2O2(g)= H2O (l)△H= -285.8KJ/mol |
| D.2H2(g)+ O2(g) = 2H2O (g)△H=" -571.6KJ/mol" |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
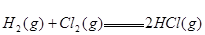 ;
;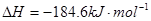 ,则反应
,则反应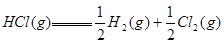 的△H为( )
的△H为( )| A.+184 KJ/mol | B.-92.3 KJ/mol | C.-369 KJ/mol | D.+92.3 KJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)。
CH3OH(g)。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.使用合适的催化剂 | D.充入He,使体系总压强增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.2Q | B.0.1Q | C.5Q | D.10Q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
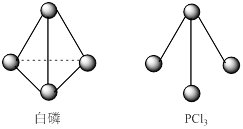
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com