
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 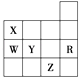
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物还原性小于Y的氢化物
D.Y元素的非金属性比W元素的非金属性强
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b B. 混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
C. 混合溶液的pH=7 D. 混合溶液中,c(H+)=![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X均为短周期元素形成的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。请回答以下问题:

(1)若A为单质,且C为一元强酸。
①组成单质A的元素在元素周期表中的位置为__________。
②写出一种工业制备单质A方法的离子方程式: __________。
③X可能为________(填字母代号)。
a.NaOH b. AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成的G的浓溶液遇C有白烟产生。
①A的电子式为__________。
②A与H2O反应的化学方程式为__________。
③G的浓溶液遇C产生白烟的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1为甲烷和O2构成的燃料电池示意图,电解质溶液为KOH溶液;图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A. b电极为负极
B. 图1中电解质溶液的pH增大
C. a电极反应式为CH4-8e-+8OH-=CO2+6H2O
D. 图2中电解AlCl3溶液的总反应式为: 2AlCl3+6H2O ![]() 2Al(OH)3↓+3Cl2↑+3H2↑
2Al(OH)3↓+3Cl2↑+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
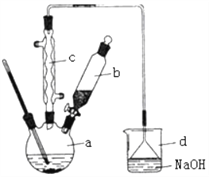
【题目】Ⅰ.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液态溴。向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生的化学方程式为_______________________;继续滴加至液溴滴完。仪器a的名称是___________装置d中的作用是_______________________。仪器c为冷凝管,其进水口为__________________(填“上”或“下”)口。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______________________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为____,要进一步提纯,下列操作中必须的是____。
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜和镁组成的2.24g混合物投入适量某浓度的硝酸中完全反应,还原产物中有NO2、NO、N2O三种气体,且体积均为0.224L(标准状况),然后向反应后的溶液中,加入足量的NaOH溶液,所得沉淀经过滤、洗涤、干燥后称量,质量为
A. 3.12g B. 4.28g C. 4.68g D. 5.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( ) 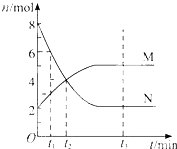
A.反应的化学方程式为:2MN
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 已知:HCN(aq)+NaOH(aq)═NaCN(aq)+H2O(l)△H=﹣12.1kJmol﹣1;HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=﹣55.6kJmol﹣1。则在水溶液中HCN![]() H++ CN-电离的△H为_______________kJmol﹣1
H++ CN-电离的△H为_______________kJmol﹣1
II 用右图所示装置进行中和热测定实验,请回答下列问题:
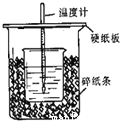
(1)大小烧杯之间填满碎泡沫塑料的作用是_____________,从实验装置上看,图中缺少的一种玻璃仪器______________。
(2)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”.“不相等”),所求中和热______________ (填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_____________ (填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com