
分析 (1)二氧化氮和水反应生成硝酸和一氧化氮;
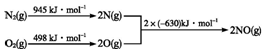
(2)①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和;
②根据反应热判断,升高温度,平衡向吸热方向移动;
(3)甲醇脱水反应 ①2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=-23.9kJ•mol-1
甲醇制烯烃反应 ②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ•mol-1
乙醇异构化反应 ③C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol-1,
根据盖斯定律①-②-③计算.
解答 解:(1)二氧化氮和水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(2)①该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol;
②正反应吸热,升高温度,平衡正向移动,则平衡常数增大,故答案为:增大;
(3)甲醇脱水反应 ①2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=-23.9kJ•mol-1
甲醇制烯烃反应 ②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ•mol-1
乙醇异构化反应 ③C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol-1,
根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=(-23.9+29.1-50.7)kJ/mol=-45.5kJ/mol;
故答案为:-45.5.
点评 本题考查了热化学方程式的计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度中等,注意掌握盖斯定律在热化学方程式的计算中的应用.


科目:高中化学 来源: 题型:选择题
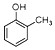 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )| A. | 4类 | B. | 5类 | C. | 6类 | D. | 8类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | Fe在O2中的燃烧产物可用于制红色涂料 | |
| C. | 瓷坩埚能耐高温,可用于加热熔化烧碱、纯碱等固体 | |
| D. | Mg (OH)2分解吸热且生成高熔点固体,可用作阻燃剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.lmolN5+离子中所含的电子数为3.4 NA | |
| C. | 2mol金属铝与足量的盐酸反应,共失去了4NA个电子 | |
| D. | 16 g氧气和16 g臭氧所含的原子数均为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 CaCl2溶液 | ||
| C. | 150 mL 3 mol•L-1 KCl溶液 | D. | 75 mL 3 mol•L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL质量分数为98%的H2SO4用10mL水稀释后;H2SO4的质量分数大于49% | |
| B. | 在标准状况下,将11.2 L氨气溶于500mL水中,得到1mol•L-1的氨水 | |
| C. | 配制0.1 mol•L-1的Na2CO3溶液480mL,需用500ml容量瓶 | |
| D. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com