
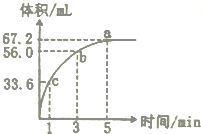
 某“学习小组”研究影响化学反应速率的因素.向10 mL某浓度的H2O2溶解中加入一定量MnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示,
某“学习小组”研究影响化学反应速率的因素.向10 mL某浓度的H2O2溶解中加入一定量MnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示,分析 (1)反应速率随反应物浓度减小而减小;
(2)根据v(O2)=$\frac{△V}{△t}$计算;
(3)由图象可知,生成氧气的体积为67.2mL;根据氧气的量计算双氧水的物质的量,再根据C=$\frac{n}{V}$计算物质的量浓度;
(4)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量.
解答 解:(1)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,即反应速率为c>b>a,
故答案为:c;b;a;双氧水的浓度逐渐减小;
(2)v(O2)=$\frac{△V}{△t}$=$\frac{(67.2-56.0)mL}{2min}$=5.6mL/min;
故答案为:5.6;
(3)由图象可知,生成氧气的体积为67.2mL;
设双氧水的物质的量为x,
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2mol 22.4L
x 0.0672L
x=$\frac{2mol×0.0672L}{22.4L}$=0.006mol,
所以其物质的量浓度=$\frac{0.006mol}{0.01L}$=0.6 mol•L-1,
故答案为:67.2;0.6mol/L;
(4)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;
B.加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;
C.加入NaNO3溶液,Zn与氢离子和硝酸根离子生成NO气体,影响生成氢气的量,故C错误;
D.加入CuSO4溶液,Zn置换出Cu反应速度增大,故D错误;
E.加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误.
故答案为:A、B.
点评 本题考查实验方案设计、反应速率的计算,侧重于综合考查学生的实验设计和分析能力,通过得到气体的体积和时间的关系确定影响反应速率的因素,难度中等.


科目:高中化学 来源: 题型:解答题
| 序号 | 待测物质 | 加入试剂 | 操作方法 |
| ① | 乙醛(乙酸) | NaOH溶液 | |
| ② | CH3CH2OH(水) | ||
| ③ | 苯(苯酚) | ||
| ④ | 乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
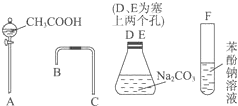 设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.
设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1 mol.L-1SO2的溶液.中:Na+、Ba2+、Br-、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、Mg2+、N03-、SO42- | |
| C. | $\frac{C{(H}^{+})}{C({OH}^{-})}$=10-12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 不能使酚酞变红的无色溶液中:Na+、K+、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | |
| B. | 利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 向淀粉碘化钾溶液中加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2=2I2+2H20 | |
| D. | 用盐酸洗涤试管中的Cu(OH)2:Cu(OH)2+2H+=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pX=-lgc(X).下列说法正确的是( )| A. | 在该温度下,MgCO3、MnCO3 的溶解度依次增大 | |
| B. | d点可表示MnCO3的过饱和溶液,且c(Mn2+)>c(CO32-) | |
| C. | b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | |
| D. | c点可表示MgCO3 的不饱和溶液,且c(Mg2+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M(NO3)2 | B. | M(NO3)3 | C. | MNO3 | D. | M2(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com