
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ⑤⑥ |
分析 ①SiO2与氢氧化钠反应生成硅酸钠和水;
②Fe(OH)2与氧气、水反应生成Fe(OH)3;
③SiO2不溶于水,与水不反应;
④Al2O3不溶于水,与水不反应;
⑤Ca(OH)2→与碳酸钠反应生成碳酸钙和NaOH;
⑥NaAlO2与足量盐酸反应生成AlCl3和氯化钠、水;
解答 解:①SiO2与氢氧化钠反应生成硅酸钠和水,所以SiO2→Na2SiO3能够一步实现,故正确;
②Fe(OH)2与氧气、水反应生成Fe(OH)3,所以Fe(OH)2→Fe(OH)3 能够一步实现,故正确;
③SiO2不溶于水,与水不反应,所以SiO2→Na2SiO3不能够一步实现,故错误;
④Al2O3不溶于水,与水不反应,所以Al2O3→Al(OH)3不能够一步实现,故错误;
⑤Ca(OH)2→与碳酸钠反应生成碳酸钙和NaOH,所以Ca(OH)2→NaOH 能够一步实现,故正确;
⑥NaAlO2与足量盐酸反应生成AlCl3和氯化钠、水,所以NaAlO2→AlCl3能够一步实现,故正确;
故选:B.
点评 本题考查了物质相互之间的转化,明确物质的性质是解题关键,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ③④⑤ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| D | 验证苯和液溴在FeBr3的催化下发生取代反应 | 将反应产生的混合气体先通入溴的四氯化碳溶液再通入AgNO3溶液中,观察是否有淡黄色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W | Q |
| 原子半径/pm | 160 | 143 | 70 | 66 | 102 |
| 主要化合价 | +2 | +3 | +5、-3 | -2 | +6、-2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 氢化物的沸点 H2W>H2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质中化学键破坏了,一定发生了化学变化 | |
| B. | 水的沸点比硫化氢高,是因为水中的化学键比硫化氢中的化学键强 | |
| C. | 第三周期元素的离子半径逐渐变小 | |
| D. | 共价化合物中一定存在化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
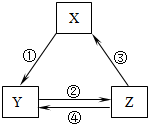 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 | ③加入盐酸 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
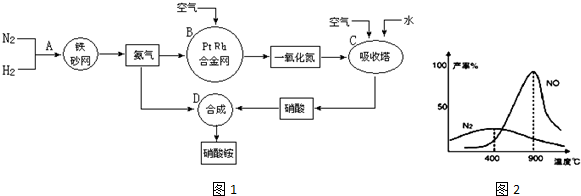
 4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.
4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和石墨互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | 分子式为C4H10的物质为纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com