
下列推断正确的是( )
A.BF3是三角锥形分子
B.NH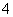 的电子式:
的电子式: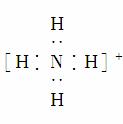 ,该离子呈平面正方形结构
,该离子呈平面正方形结构
C.CH4分子中的4个C—H键都是由氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D.CH4分子中,碳原子中的sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H键
科目:高中化学 来源: 题型:
铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是________。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
(4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定都是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期;B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子,试回答下列问题:
(1)写出五种元素的名称:
A__________,B__________,C__________,
D__________,E__________。
(2)写出A、B形成的AB型离子化合物与CO2反应的化学方程式。
(3)写出D元素形成的单质的结构式
(4)C、E元素形成化合物的空间构型为。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强
B.含极性键的分子一定是极性分子
C.判断A2B或AB2型分子为极性分子的依据:具有极性键且分子构型不对称、键角小于180°的非直线形结构
D.非极性分子中,各原子间不一定以非极性键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
用“酸性”、“碱性”、“中性”或“不确定”填空。
(1)pH<7的溶液( )
(2)pH=7的溶液( )
(3)c(H+)=c(OH-)的溶液( )
(4)c(H+)=1×10-7mol·L-1的溶液( )
(5)c(H+)>c(OH-)的溶液( )
(6)0.1 mol·L-1的NH4Cl溶液( )
(7)0.1 mol·L-1的NaHCO3溶液( )
(8)0.1 mol·L-1的NaHSO3溶液( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是①向饱和碳酸钠溶液中通入过量的CO2;②向NaAlO2溶液中逐滴加入过量的稀盐酸;③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③
C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com