
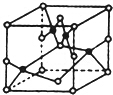
 A、B、C、D、E、F六种元素的原子序数依次增大.已知:F的原子序数为29,其余均为短周 期主族元素;E原子价电子(外围电子)排布式为 msnmpn-1;D原子的最外层电子数为偶数;A、C原子 的P轨道上都有两个未成对电子.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.已知:F的原子序数为29,其余均为短周 期主族元素;E原子价电子(外围电子)排布式为 msnmpn-1;D原子的最外层电子数为偶数;A、C原子 的P轨道上都有两个未成对电子.请回答下列问题:分析 A、B、C、D、E、F六种元素的原子序数依次增大,F的原子序数为29,则F为铜元素;E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素,A、C原子的P轨道上都有两个未成对电子,所以A、C原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;C核外电子排布式为1s22s22p4,则C为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素,D原子最外层电子数为偶数,D原子序数介于氧元素与铝元素之间,则D为镁元素,由此分析解答.
解答 解:A、B、C、D、E、F六种元素的原子序数依次增大,F的原子序数为29,则F为铜元素;E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素,A、C原子的P轨道上都有两个未成对电子,所以A、C原子p轨道的电子数分别为2和4,则A核外电子排布式为1s22s22p2,则A为碳元素;C核外电子排布式为1s22s22p4,则C为氧元素.B元素原子序数介于碳元素与氧元素之间,则B为氮元素;E原子价电子(外围电子)排布为msnmpn-1,s能级容纳2个电子,则E外围电子排布为ms2mp1,原子序数大于氧元素,则E为铝元素,D原子最外层电子数为偶数,D原子序数介于氧元素与铝元素之间,则D为镁元素,
(1)A、同周期自左而右基态原子第一电离能增大,基态原子第一电离能:D>E,故A正确;
B、氮化铝晶体与金刚石类似,均是正四面体结构,每个铝原子与4个氮原子相连,是由原子构成的原子晶体,故B错误;
C、同周期自左而右电负性增大,故电负性C<N<O,故C正确;
故选:AC;
(2)F为铜元素,核内质子数为29,核外电子数为29,核外电子排布式是1s22s22p63s23p63d104s1;
与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素,价层电子排布为3d54s1,核外电子排布式是1s22s22p63s23p63d54s1,是Cr元素,
故答案为:1s22s22p63s23p63d54s1;
(3)A为碳元素,C为氧元素,形成的非极性分子O=C=O中,碳氧双键中,是直线型,所以氮气也是直线型,所以氮是sp杂化,故答案为:sp;
(4)该晶胞中铜原子个数为4,氧离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以所以化学式为CuO,故答案为:CuO.
点评 本题考查物质结构与性质,明确位置、结构、性质的关系是解答的关键,此题综合性较强,涉及物质结构知识点比较多,考察比较全面,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| B. | 向碳酸氢钙溶液中滴入少量的NaOH溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 在Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 草酸和氨水反应:HOOC-COOH+2NH3•H2O═C2O42-+2NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:7 | C. | 1:1 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸有吸水性,可用于干燥氨气 | |
| B. | SiO2是酸性氧化物,不与任何酸反应 | |
| C. | Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱 | |
| D. | SO2通入少量紫色石蕊溶液,溶液始终呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子是正方形分子 | |
| B. | 乙烯是平面形结构 | |
| C. | 乙炔分子中的4个原子在同一条直线上 | |
| D. | 丙炔的三个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
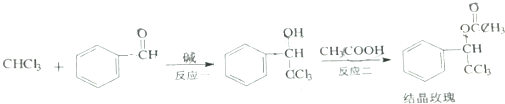
| A. | 反应一是加成反应 | |
| B. | 反应二的发生可用浓硫酸做催化剂 | |
| C. | 结晶玫瑰分子式为C10H9Cl3O2 | |
| D. | 上述过程中所有有机物的官能团共有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.75g | B. | 18.59g | C. | 26.1g | D. | 26.33g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com