
| 48m |
| 54 |
| 22m |
| 24 |
| 22m |
| 24 |
| 48m |
| 54 |
| 22×10 |
| 24 |
| 54 |
| 48 |
| 10+x | ||
|


科目:高中化学 来源: 题型:
| 反应物 | Na2S2O3溶液 | H2SO4溶液 | 水 | ||
| 甲 | 0.1 mol?L-1 | 10 mL | 0.1 mol?L-1 | 10 mL | 5 mL |
| 乙 | 0.2 mol?L-1 | 5 mL | 0.2 mol?L-1 | 5 mL | 20 mL |
| A、甲>乙 | B、甲<乙 |
| C、甲=乙 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用CaCl2溶液鉴别 |
| B、存在的粒子种类相同 |
| C、c(OH-)前者大于后者 |
| D、分别加入NaOH固体,恢复到原温度时,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | CO2 | SO2 | Ba(NO3)2 |
| ③ | NO2 | SO2 | BaCl2 |
| ④ | CO2 | NH3 | CaCl2 |
| A、②③④ | B、①②③ |
| C、①②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热至沸腾 |
| B、加少量NaOH |
| C、加100ml水 |
| D、加20ml0.4mol/LNH3?H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、I-、CO32-、SO42- |
| B、Ca2+、H+、K+、HCO3- |
| C、Mg2+、Na+、SCN-、Cl- |
| D、Cu2+、Ba2+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
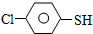 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.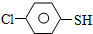 及X的核磁共振氢谱如图2,其中
及X的核磁共振氢谱如图2,其中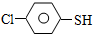 的核磁共振氢谱图.写出X的结构简式:
的核磁共振氢谱图.写出X的结构简式: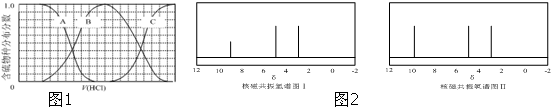
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com