
����Ŀ�� (ʵ��)ij������A������ת����ϵ����Ҫ����գ�
��1��д��D�����������ŵ����� ��ָ���ݵķ�Ӧ���� ��
��2����Ӧ�ڵķ�Ӧ������ ��
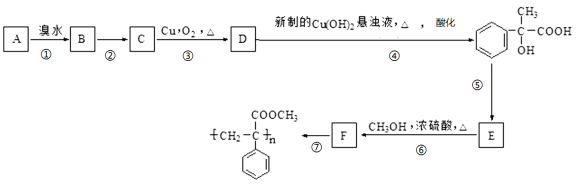
��3��д��A��F�ṹ��ʽ��A ��F ��
��4��д����Ӧ�۶�Ӧ�Ļ�ѧ����ʽ�� ��
��5��д��D������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽ�� ��
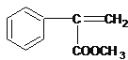
��6��E��������������ͬ���칹���ж��֣���д����һ����ͬʱ���������������칹��Ľṹ��ʽ ��
a�������ϵ�һ�ȴ���������
b����FeCl3��Һ������ɫ��Ӧ
c������Br2/CCl4�����ӳɷ�Ӧ
���𰸡�
��1�� ȩ�����ǻ�����ȥ��Ӧ
��2��KOHˮ��Һ������
��3��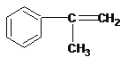 ��
��
��4��
��5��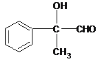 ��NaOH��2Cu(OH)2
��NaOH��2Cu(OH)2![]()
 ��Cu2O����3H2O
��Cu2O����3H2O
��6��![]()
��������
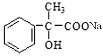
���������D�����Ʊ�������ͭ��Ӧ�����֪DӦΪ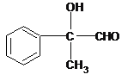 ����CΪ
����CΪ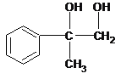 ��BΪ
��BΪ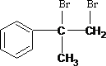 ����AΪ
����AΪ �������ղ����֪FΪ
�������ղ����֪FΪ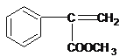 ����EΪ
����EΪ![]() ��
��
��1��DΪ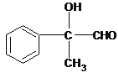 ���������������ȩ�����ǻ�������E�ķ�ӦΪ��ȥ��Ӧ���ʴ�Ϊ��ȩ�����ǻ�����ȥ��Ӧ��
���������������ȩ�����ǻ�������E�ķ�ӦΪ��ȥ��Ӧ���ʴ�Ϊ��ȩ�����ǻ�����ȥ��Ӧ��
��2��CΪ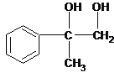 ��BΪ
��BΪ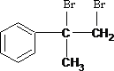 ��B��KOH��ˮ��Һ���ȷ�����ȥ��Ӧ����C�����Է�Ӧ������KOHˮ��Һ��������
��B��KOH��ˮ��Һ���ȷ�����ȥ��Ӧ����C�����Է�Ӧ������KOHˮ��Һ��������
�ʴ�Ϊ��KOHˮ��Һ�����ȣ�
��3��Ϊ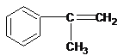 �������ղ����֪FΪ
�������ղ����֪FΪ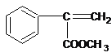 ��
��
�ʴ�Ϊ�� ��
��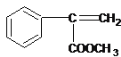 ��
��
��4����Ӧ��Ϊ ��Cu�����������·���������Ӧ����
��Cu�����������·���������Ӧ����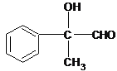 �ķ�Ӧ����
�ķ�Ӧ����
ʽΪ��2 +O2
+O2![]() 2
2  +2H2O��
+2H2O��
�ʴ�Ϊ��2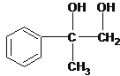 +O2
+O2![]() 2
2 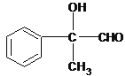 +2H2O��
+2H2O��
��5��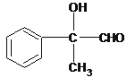 �к���ȩ�����ܱ�����������ͭ����Һ��������-COOH����Ӧ����ʽΪ
�к���ȩ�����ܱ�����������ͭ����Һ��������-COOH����Ӧ����ʽΪ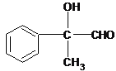 +2Cu(OH)2
+2Cu(OH)2 ![]()
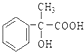 +Cu2O��+2H2O��
+Cu2O��+2H2O��
�ʴ�Ϊ�� +2Cu(OH)2
+2Cu(OH)2 ![]()
 +Cu2O��+2H2O��
+Cu2O��+2H2O��
��6��EΪ![]() ��E��ͬ���칹���������������a�������ϵ�һ�ȴ��������֣�˵�������Ϻ���������ԭ�ӣ�b����FeCl3��Һ������ɫ��Ӧ˵�����з��ǻ���������Br2/CCl4�����ӳɷ�Ӧ˵������̼̼˫��������������ͬ���칹��ṹ��ʽΪ
��E��ͬ���칹���������������a�������ϵ�һ�ȴ��������֣�˵�������Ϻ���������ԭ�ӣ�b����FeCl3��Һ������ɫ��Ӧ˵�����з��ǻ���������Br2/CCl4�����ӳɷ�Ӧ˵������̼̼˫��������������ͬ���칹��ṹ��ʽΪ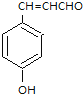 ��
��
�ʴ�Ϊ�� ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿��֪��
![]()
![]() ��C��CH+��
��C��CH+��![]() ��H
��H![]() ��C��C��
��C��C��![]()
��CHO+![]()
![]() ��
��![]()
![]()
����ȲΪԭ�ϣ�ͨ����ͼ��ʾ�����ܺϳ��л��м���E��ת�������еķ�Ӧ���������ֲ�������ȥ����
![]()
![]() C2H2
C2H2![]() A
A![]() B
B![]() C
C![]() D
D![]() E��H��
E��H��![]()
![]()
![]() ��H
��H
������A��B��C��D�ֱ����һ���л�����B�Ļ�ѧʽΪC4H10O2������������
��ش��������⣺
��1��A����B�Ļ�ѧ��Ӧ������_________________��
��2��д������A�Ļ�ѧ��Ӧ����ʽ_________________________________________��
��3��B��Ũ������¼��ȣ������ɶ����л����д��2����Է���������AС���л�����Ľṹ��ʽ:_________________��__________________��
��4��д��C����D�Ļ�ѧ��Ӧ����ʽ��______________________________��
��5�����б���������E��Ϊͬ���칹�������___�֣�д������һ��ͬ���칹��Ľṹ��ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ��pH�������ͬ������ʹ���������Һ�����������������
A��������NaOH��ȫ�к�ʱ��������Һ�����ĵ�NaOH��
B�����Ƿֱ�������CaCO3��Ӧʱ���ų���CO2һ����
C��������Һ��n(Cl��)= n(CH3COO��)��ͬ
D���ֱ���ˮϡ����ͬ����ʱ��n(Cl��)��n(CH3COO��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��п��淴Ӧ��2A(g)��2B(g)![]() C(g)��3D(g) ��H��0���ֽ�2molA��2molB�������ΪV�ļ���������2molC��6molD������������ʹ�������ڷ�Ӧ��ʼǰ�����Ϊ2V(��ͼ1)��
C(g)��3D(g) ��H��0���ֽ�2molA��2molB�������ΪV�ļ���������2molC��6molD������������ʹ�������ڷ�Ӧ��ʼǰ�����Ϊ2V(��ͼ1)��

�����������з�Ӧ��˵����ȷ����
A���������еķ�Ӧ�ȴﵽ��ѧƽ��״̬
B����������ƽ���������ͬ���¶ȣ�������������D������������¶ȱ仯��ͼ2��ʾ
C���������еķ�Ӧ����ƽ��ʱ��ƽ�������и���ݵ�����ٷ������ͬ����������ƽ����Է�������Ҳ��ͬ
D���ڼ��������ٳ���2molA��2molB��ƽ����������C��Ũ������������C��Ũ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ��FeS2��SiO2�ȣ��Ʊ�Ī���ε��������£�
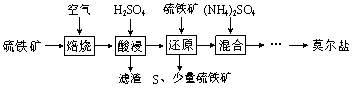
��֪������ԭ��ʱ��FeS2��H2SO4����Ӧ��Fe3+ͨ����Ӧ��ԭ�����з�Ӧ�����£�
2Fe3++ FeS2=2S��+3Fe2+
��1������ԭ��ʱ��pH���˹��ߵ�ԭ����_________��д������ԭ��ʱ��Ӧ������ӷ���ʽ��__________��
��2��ʵ���á���ԭ��ʱ��Ӧ���б���ԭ��Fe3+�����ʵ���֮��Ϊ2��7�����㡰��ԭ������ҺFe2+��Ũ�ȼ���ȷ����������(NH4)2SO4��������Һ����仯���Բ��ƣ�
���� | ����Ũ�ȣ�mol��L��1�� | |
��ԭǰ | ��ԭ�� | |
SO42�� | 3.20 | 3.50 |
Fe2+ | 0.15 | |
��3����ȡ23.52g����Ī���Σ�����ˮ�����Һ���ֳ����ȷݡ�һ�ݼ���������BaCl2��Һ���õ���ɫ����13.98g����һ����0.2000mol/LK2Cr2O7������Һ�ζ�����Cr2O72-ǡ����ȫ����ԭΪCr3+ʱ��������Һ�����Ϊ25.00mL����ȷ��Ī���εĻ�ѧʽ�������������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
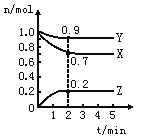
��1���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ ��
��3����X��Y��Z��Ϊ���壬2min��Ӧ�ﵽƽ�⣬��Ӧ��ƽ��ʱ������ʱ��ϵ��ѹǿ�ǿ�ʼʱ�� ����
����ƽ��ʱ�������ڻ�������ƽ������������ʼͶ��ʱ_______ _____(��������������С�����������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������Ļ�����A������Է�������Ϊ104��̼����������Ϊ92.3%��
��1��A�ķ���ʽΪ________________________��
��2��A��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ______________________________��
��3����֪��![]()
![]()
![]() �� ��д��A��ϡ�����KMnO4��Һ�ڼ��������·�Ӧ������Ľṹ��ʽ___________________________________��
�� ��д��A��ϡ�����KMnO4��Һ�ڼ��������·�Ӧ������Ľṹ��ʽ___________________________________��
��4����һ�������£�A��������Ӧ���õ��Ļ�������̼����������Ϊ85.7%��д���˻�����Ľṹ��ʽ______________________________________��
��5����һ�������£���A�ۺϵõ��ĸ߷��ӻ�����Ľṹ��ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ż�ʯ��Դ�Ĵ��������Լ���Ⱦ�ļӾ磬��Ⱦ����������Ϳ��������������С�
��1��Bunsen�Ȼ�ѧѭ�������������������Ӧ��ɣ�
SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) H=a kJ/mol ��
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) H= b kJ/mol ��
2HI(g) = H2(g) + I2(g) H= c kJ/mol ��
��2H2O(g) = 2H2(g) + O2(g) H= kJ/mol
��2��CO2 ��CH4 ��������Ҫ���������壬�Ա��渲����Cu2Al2O4 �Ķ�������Ϊ���������Խ�CO2 ��CH4ֱ��ת��Ϊ���ᡣ
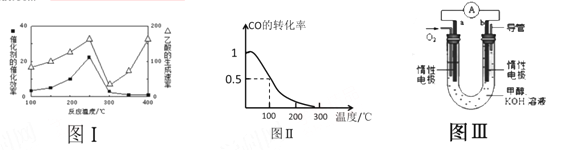
����ͬ�¶��´����Ĵ�Ч�������������������ͼ����ʾ���÷�Ӧ��ϵӦ���¶ȿ����� �����ҡ�
�ڽ�Cu2Al2O4 �ܽ���ϡ�����е����ӷ���ʽΪ ��
��3���״���CH3OH������Ϊ21���͵�����ȼ�ϡ������ΪV L��ij��Ӧ�����У�a mol CO��2a mol H2 �ڴ��������·�Ӧ���ɼ״���CO(g) + 2H2(g) ![]() CH3OH(g) ��CO��ƽ��ת�������¶ȵĹ�ϵ��ͼ����ʾ��
CH3OH(g) ��CO��ƽ��ת�������¶ȵĹ�ϵ��ͼ����ʾ��
�ٸ÷�Ӧ�� ������ȡ������ȡ�����Ӧ
���������������������£���Ӧ������������amol CO��2amolH2 ���ﵽ��ƽ��ʱ��CO��ת���� �����������С�����䡱����
��100������ӦCH3OH(g) ![]() CO(g) + 2H2(g) ��ƽ�ⳣ��Ϊ ���ú���a��V�Ĵ�����ʾ����
CO(g) + 2H2(g) ��ƽ�ⳣ��Ϊ ���ú���a��V�Ĵ�����ʾ����
��4��ijʵ��С���������ͼIII��ʾ�ļ״�ȼ�ϵ��װ�á�
�ٸõ�ع���ʱ��OH- �� ���a����b�������ƶ�
�ڹ���һ��ʱ���ø���Һ��pH��С���õ�ظ�����Ӧ�ĵ缫��ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ�����Թܷ���ʢ��25��ʱ����ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���5ml�������Թ��У��Իش��������⣺
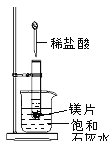
��1��ʵ���й۲쵽������ ��
��2�������������ԭ�� ��
��3��д���йط�Ӧ�����ӷ�Ӧ���� ��
��4���д���֪��MgCl2��Һ��H2�������� ��������������С����������������þƬ���������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com