
工业上制备纯硅反应的化学方程式如下:SiCl4(g)+2H2(g) = Si(s)+4HCl(g),将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若通过缩小体积增大压强,则活化分子百分数变大,反应速率加快
B.若Si-Cl、H-H、Si-Si、H-Cl的键能分别为Ea、Eb、 Ec、Ed(单位:),则△H=(4Ea+2Eb-Ec-4Ed )KJ/mol
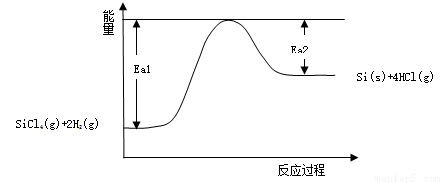
C.该反应能量变化如下图所示,则Ea1、Ea2分别代表该反应正向和逆向的活化能,使用催化剂Ea1、Ea2都减小,△H也变小
D.由下图和题目信息可知该反应△H>0,△S>0,所以在较高温度下可自发进行
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷参考版) 题型:选择题
一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中 和
和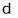 代表不同元素的原子。
代表不同元素的原子。
关于此反应说法错误的是
A.一定属于吸热反应 B.一定属于可逆反应
C.一定属于氧化还原反应 D.一定属于分解反应
查看答案和解析>>
科目:高中化学 来源:2015-2016年浙江宁波效实中学高一下期中化学卷(创)(解析版) 题型:填空题
(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g) 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
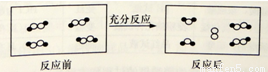
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016年浙江宁波效实中学高一下期中化学卷(创)(解析版) 题型:选择题
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
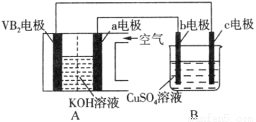
A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,c电极表面先有红色物质析出,后有气泡产生
D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016年浙江宁波效实中学高一下期中化学卷(创)(解析版) 题型:选择题
有两种短周期元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为 ① m-4 ② m+4 ③ m+8 ④ m-2 ⑤ m+6。其中正确的组合是
A.只有①②④ B.只有①②⑤ C.①②③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江杭州二中高一下期中化学试卷(解析版) 题型:选择题
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下: 2NO + 2CO
2NO + 2CO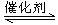 2CO2 + N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2 + N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |


 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
 (1) 前3s的平均反应速率v(N2)=_____________。(答案保留2位小数)
(1) 前3s的平均反应速率v(N2)=_____________。(答案保留2位小数)
(2) 计算4s时CO的转化率α = 。
 (3) 下列措施能提高NO和CO转变成CO2和N2的反应速率的是( )
(3) 下列措施能提高NO和CO转变成CO2和N2的反应速率的是( )
 A.选用更有效的催化剂 B.升高反应体系的温度
A.选用更有效的催化剂 B.升高反应体系的温度
 C.降低反应体系的温度 D.缩小容器的体积
C.降低反应体系的温度 D.缩小容器的体积
 (4) 研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(4) 研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/ mol·L-1 | 催化剂的比表面积/m2·g-1 |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 124 | |||
Ⅲ | 350 | 124 |

 ①请在上表格中填入剩余的实验条件数据。
①请在上表格中填入剩余的实验条件数据。
 ②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
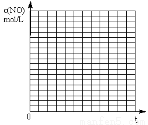
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江杭州二中高一下期中化学试卷(解析版) 题型:选择题
下列有关金属腐蚀与防护的说法不正确的是( )
A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-=4OH-
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块能保护钢制外壳不受腐蚀
D.生铁在潮湿环境中更容易生锈
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江杭州二中高一下期中化学试卷(解析版) 题型:选择题
下列各组物质的晶体中,化学键类型相同,熔化时所克服的作用力也完全相同的是( )
A.CO2和SiO2 B.NaCl和HCl C.(NH4)2CO3和CO(NH2)2 D.NaH和KCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:实验题
【加试题】乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下:
已知: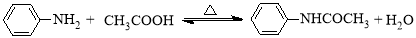
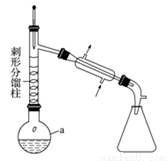
①苯胺易被氧化。
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于热水 |
苯胺 | -6 | 184.4 | 微溶于水 |
醋酸 | 16.6 | 118 | 易溶于水 |
实验步骤如下:
步骤1:在a中,加入9mL (0.10 mol)苯胺、15 mL(0.27 mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全。
步骤3:趁热将反应混合物倒入盛有100 mL 冷水的烧杯中,冷却后抽滤、洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)仪器a的名称为 ,所选仪器a的最佳规格是 (填序号)。
A. 25 mL B.50 mL C.100 mL D.250 mL
(2)实验中加入少许锌粉的目的是 。
(3)步骤2中,控制温度计读数在105℃左右的原因是 。
(4)判断反应已基本完全的方法为 。
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是 。
(6)步骤4中粗产品进一步提纯,该提纯方法是 。
(7)本次实验的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com