
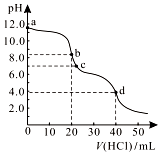
 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )| A. | a点溶液呈碱性的原因用离子方程式表示为:CO32-+2H2O?H2CO3+2OH- | |
| B. | c点处的溶液中c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-) | |
| C. | 滴定过程中使用甲基橙作为指示剂比酚酞更准确 | |
| D. | d点处溶液中水电离出的c(H+)大于b点处 |
分析 A.碳酸根离子的水解分步进行,主要以第一步为主,水解方程式写出第一步即可;
B.c点溶液的pH=7,根据电荷守恒分析;
C.甲基橙的变色范围是3.1-4.4,在b点是溶液颜色突变的点,碳酸钠和盐酸按照1:2反应时会产生二氧化碳;
D.d点溶液呈酸性,抑制了水的电离,b点碳酸氢根离子的水解,促进了水的电离.
解答 解:A.a点为Na2CO3溶液,碳酸根离子部分水解,溶液呈碱性,碳酸根离子的水解一第一步为主,正确的离子方程式为:CO32-+H2O?HCO3-+OH-,故A错误;
B.c点的pH=7,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+2c(CO32-)+c(OH-)可知:c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-),故B正确;
C.碳酸氢钠溶液的pH接近8.2,与酚酞变色的pH接近,变色时的pH和反应终点的pH不好判断;而使用甲基橙容易判断终点,且反应产生的二氧化碳不能全部逸出使溶液偏酸性,因此使用甲基橙的误差小(使用甲基橙易判断滴定终点,误差小),故C正确;
D.b点碳酸氢根离子水解,促进了水的电离,而d点溶液呈酸性,抑制了水的电离,则d点处溶液中水电离出的c(H+)小于b点处,故D错误;
故选BC.
点评 本题考查了酸碱中和滴定的应用,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握中和滴定侧重方法,试题培养了学生的分析能力及化学实验能力.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醚和乙醇互为同分异构体 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 聚氯乙烯可用作生产食品包装材料的原料 | |
| D. | 分子式为C3H8O的有机物,只有2种能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测得NaC1O溶液的pH为10 | |
| B. | 用澄清石灰水鉴别Na2CO3溶液与NaHCO3溶液 | |
| C. | 向Fe(NO3)2溶液中滴加稀盐酸,无明显现象 | |
| D. | 向K2Cr2O7溶液中滴加NaOH溶液,溶液逐渐变黄 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题: .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com