
水是生命之源。饮用水消毒作为控制水质的一个重要环节,液氯消毒是最早的饮用水消毒方法。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)氯气溶于水能杀菌消毒的原因是 。
(2)在ClO2的制备方法中,有下列两种制备方法:
方法一:NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO2-也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式 。
②配制Na2S2O3标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的 (填字母代号)。




a b c d e
③请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:调节溶液的pH≤2.0。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
④滴定终点的现象是 。
⑤根据上述分析数据,测得该引用水样中的ClO2-的浓度为 mg·L-1(用含字母的代数式表示)。
(4)判断下列操作对ClO2-的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,使测定结果 。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果 。
(1)生成的HClO具有强氧化性,可以杀菌(2分)
(2)方法二制备的ClO2中不含Cl2(2分)
(3)①ClO2-+4H++4I-=Cl-+2I2+2H2O(2分)
②a c(2分)
③(溶液由蓝色变为无色,(2分)⑤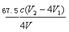 ×103(2分)
×103(2分)
(4)①偏高 (2分) ②偏低(2分)
解析试题分析:(1)氯气的自来水消毒属于氢氧化性消毒,因此原理是氯气与水反应生成的HClO有强氧化性,起到杀菌消毒作用。
(2)根据题干中的介绍,氯气用于自来水消毒容易生成对人体有害的有机氯代物,所以方法二中产生的ClO2气体中不含氯气,因此制得的二氧化氯更加的安全。
(3) ①从本题题干和图像中得知,溶液pH≤2.0时,ClO2-被I- 还原为Cl- ,因此反应的离子方程式为ClO2-+4H++4I-=Cl-+2I2+2H2O,要注意酸性环境。
②一定浓度溶液的配制需要使用的仪器主要的还有容量瓶、胶头滴管,故选ac。④待滴定溶液中含有碘单质,因此与淀粉作用显蓝色,所以加入Na2S2O3 与单质碘反应,当碘反应完的时候,溶液不显蓝色,故描述时要注意规范表达。
⑤本小题计算稍微有些复杂,首先要了解整个滴定的过程:含有ClO2、ClO2- 的水,碱性下加KI溶液把ClO2 反应为ClO2- ,生成的碘单质用标准液滴定;得到的总的ClO2- 再在酸性条件下与KI反应,又生成一部分碘单质,再用标准液滴定。因此整个过程分为两个阶段。
第一步滴定(生成了一部分ClO2- ):2ClO2+2I-= 2ClO2- + I2
2Na2S2O3 + I2 =Na2S4O6+2NaI
cV1 0.5cV1 cV1 0.5cV1
第二步滴定(反应总的ClO2- )ClO2-+ 4H++4I-=Cl-+ 2I2 +2H2O
2Na2S2O3+I2 = Na2S4O6+2NaI
0.25cV2 0.5cV2 cV2 0.5cV2
引用水样中的ClO2-的浓度等于总的ClO2-减去第一步滴定产生的ClO2- ,因此有:
C(ClO2-)=n总(ClO2-)—n(ClO2-)/V=0.25cV2—cV1 /V,要注意化成质量浓度,所以C(ClO2-)=  ×103 mg·L-1 。
×103 mg·L-1 。
(4)①滴定过程中若有标准液溅出损失,则从滴定管上读出的标准液体积偏高,所以计算得到的浓度结果会偏大。
②若在滴定终点读取标准液体积时,俯视读数,则读出的标准液体积会偏小,所以计算得到的浓度会偏低。
考点:本题考查的氧化还原滴定实验探究、计算、误差分析。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:填空题
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)火力发电厂为除去有害气体SO2,并变废为宝,常采用尾气脱硫工艺,如图所示。写出尾气脱硫工艺中反应的化学方程式: 。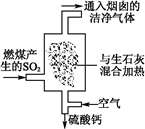
(2)宁波的火力发电厂通常建在海边,一般海水呈弱碱性,主要含有Na+、Mg2+、K+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。含有SO2的烟气也可以利用海水脱硫,其工艺流程如下图所示: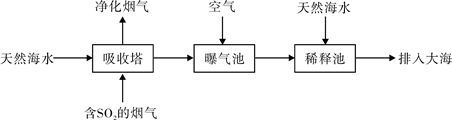
①向曝气池通入空气的目的是 。
②通入空气后的曝气池中的海水与天然海水相比,浓度有明显不同的离子是 。
| A.Cl- | B.Na+ | C.Mg2+ | D.HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是 。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。

将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是 ,处理从氯化塔中逸出气体的方法是 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是 ,其原因可能是 ,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O △H2= -534.2kJ·mol-1
写出肼和N2H4反应的热化学方程式 ;
(3)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校化学研究性学习小组,在学习金属的冶炼以后对一氧化碳还原金属氧化物的实验非常感兴趣,他们查阅有关资料后发现,一氧化碳的制备可利用甲酸和浓硫酸共热到60~80 ℃发生脱水反应制取:
HCOOH CO↑+H2O
CO↑+H2O
请根据以下各图帮他们组装成一套相对合理的实验装置图(某些装置可重复使用)。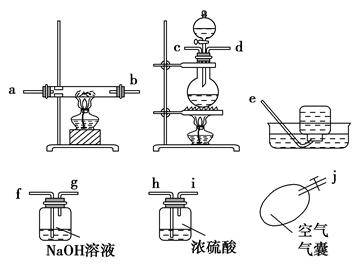
回答以下问题:
(1)合理实验装置的连接顺序是(写小写字母) 。
(2)在反应时一定要先通一会一氧化碳气体,然后再点燃加热氧化铁的酒精灯,原因是 。
| A.因为一般反应从左到右进行 |
| B.排除体系内的空气,使反应过程更安全 |
| C.甲酸与浓硫酸反应可以产生大量的CO |
| D.此反应加热时间长有利于产生CO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校课外小组的学生,利用排饱和食盐水的方法收集了一平底烧瓶的氯气,同时制备了一平底烧瓶的饱和氯水,探究完成以下性质实验。请按照要求完成下列问题:
(1)按如图安装好实验装置,U形管内盛有有色墨水,A、B两端液面相平,平底烧瓶盛满氯气。通过分液漏斗向平底烧瓶中滴加少量氢氧化钠溶液,观察到实验现象是 、 。请简单解释原因 。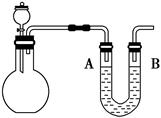
(2)如图所示,平底烧瓶盛满饱和氯水,当日光照射到盛有饱和氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是 ;当氯水中不再产生气泡时,某学生欲检验该反应所产生的气体,该同学可采取的合理操作是 。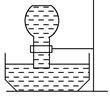
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是氮元素的几种价态与物质类别的对应关系: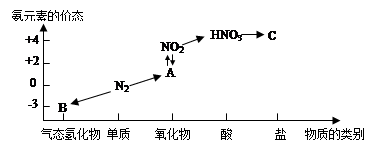
回答下列问题:
(1)写出N2的一种用途 。
(2)从N元素化合价分析,N2具有氧化性和还原性。各举一例说明(用化学方程式表示)
答:氧化性 。
还原性 。
(3)HNO3与上图中的物质C常用于检验Cl-的存在,则C的化学式为________。
(4)实验室制取物质B的化学方程式为 。
(5)NO2与水反应生成物质A的化学方程式为 。
(6)浓硝酸与木炭在加热条件下反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅及其化合物对人类现代文明的发展具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
| A.①②⑤ | B.③④⑤ | C.②③④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式____________________________。
②以下是对硝酸型酸雨的评价,其中正确的是_________________________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_______。
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)_______,它对环境的负面影响是____________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com