
【题目】下列说法正确的是
①1 mol羟基所含电子数为10NA;
②一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液中含NH4+的物质的量小于0.5NA;
③1 mol臭氧和1.5 mol氧气含有相同的氧原子数;
④58.5 g的NaCl固体中含有NA个氯化钠分子;
⑤在反应KIO3+6HI==KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA;
⑥标准状况下,2.24 L H2O含有的分子数等于0.1NA;
⑦1 mol 乙烷分子中含有8NA个共价键;
⑧78gNa2O2中含有NA个阴离子;
⑨常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023;
⑩4.0 g重水(D2O)中所含质子数为2NA。
A. ④⑤⑦⑧⑨ B. ②③⑧⑩ C. 只有③ D. 全部
【答案】B
【解析】
①羟基为-OH,1mol羟基所含电子物质的量为9mol,故①错误;②NH4Cl为强酸弱碱盐,NH4+发生水解,因此NH4+物质的量小于0.5mol,故②正确;③1molO3中含有氧原子物质的量为3mol,1.5molO2含有氧原子物质的量为1.5×2mol=3mol,故③正确;④NaCl为离子化合物,不含NaCl分子,故④错误;⑤生成3molI2,消耗1molKIO3,此时转移电子物质的量为5mol,故⑤错误;⑥标准状况下,H2O不是气体,故⑥错误;⑦乙烷结构简式为CH3CH3,1mol乙烷中含有共价键物质的量为7mol,故⑦错误;⑧过氧化钠的电子式为![]() ,78gNa2O2中含有阴离子物质的量为1mol,故⑧正确;⑨Cl2与NaOH发生Cl2+2NaOH=NaCl+NaClO+H2O,7.1gCl2与NaOH参与反应,转移电子物质的量为0.1mol,故⑨错误;⑩D2O摩尔质量为20g·mol-1,4gD2O所含质子数为4×10/20 mol=2mol,故⑩正确;综上所述,选项B正确。
,78gNa2O2中含有阴离子物质的量为1mol,故⑧正确;⑨Cl2与NaOH发生Cl2+2NaOH=NaCl+NaClO+H2O,7.1gCl2与NaOH参与反应,转移电子物质的量为0.1mol,故⑨错误;⑩D2O摩尔质量为20g·mol-1,4gD2O所含质子数为4×10/20 mol=2mol,故⑩正确;综上所述,选项B正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物;元素C与元素D可形成D2C、D2C2两种化合物;元素B形成的化合物种类繁多且元素B与元素E处于同一主族;元素C与元素F处于同一主族。
(1)写出C的元素符号__________,D形成简单离子的结构示意图___________;
(2)写出元素A一种原子的中子数是质子数2倍的核素的符号____________;
(3)元素E在周期表中位置___________;
(4)比较E和F最高价氧化物对应水化物的酸性强弱______________(用化学式表示)
(5)写出A2C2电子式___________________;D与A形成化合物电子式_________________;元素A与B形成化合物A2B2的结构式________________;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨等特点,推测该晶体是_________晶体。
(7)写出C与D以原子个数比1∶1形成的化合物与水反应的化学方程式:_________________;若生成0.5 mol氧化产物,则转移的电子数目为__________(用NA表示);
(8)取8.3g仅由D和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,写出该化合物与过量盐酸反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:为使空气质量达标,完成二氧化硫,氮氧化物排放量下降的目标,离不开各种化学处理方法。一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO3(g)△H=-296kJ·mol-1
SO3(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是___________________。
Ⅱ:如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
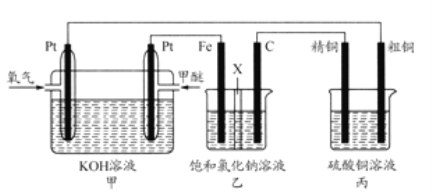
(1)甲醚燃料电池的负极反应式____________。
(2)石墨电极(C)的电极反应式为____________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____________(填“增大”“减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为____________;则乙装置中生成标况下气体的体积为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应。用上述两种方法都可制得的氯化物是( )
A.氯化铜B.氯化亚铁C.氯化铁D.氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:

(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是______________。
(2)写出步骤①中发生反应的离子方程式___________
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?________。若合理,请用离子方程式解释其原因_________________________________(若你认为不合理,该空不作答)。

II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:_____________________________
(2)实验②的化学反应中转移电子的物质的量是_______________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用NaOH溶液吸收尾气中的H2S气体,再将得到的Na2S溶液进行电解制得NaOH溶液,以实现NaOH的循环利用。电解装置如图所示,电极材料均为石墨,ab、cd均为离子交换膜。下列叙述不正确的是
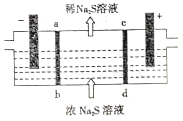
A. ab 表示阳离子交换膜,cd 表示阴离子交换膜
B. 阴极的电极反应式为2H2O-4e-==O2↑+4H+,阴极区溶液pH降低
C. 阳极的电极反应式为S2--2e-==S↓,阳极区有淡黄色沉淀产生
D. 当电路中转移1mol电子时,会有11.2 L (标准状况)的气体生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com