
| A. | 刚充入时反应速率υ正减少,υ逆增大 | |
| B. | 平衡向正反应方向移动 | |
| C. | 平衡向逆反应方向移动 | |
| D. | 物质C的质量分数增大 |
分析 达到平衡,n(A):n(B):n(C)=2:2:1.若保持温度不变,以n(A):n(B):n(C)=2:2:1的比例向该容器中再充入A、B和C,相当于在原来的基础上缩小体积,增大压强,根据压强对平衡移动的影响判断.
解答 解:达到平衡,此时测得n(A):n(B):n(C)=2:2:1.若保持温度不变,以n(A):n(B):n(C)=2:2:1的比例向该容器中再充入A、B和C,相当于在原来的基础上缩小体积,增大压强,反应前气体的化学计量数之和大于生成物的气体化学计量数之和,则增大压强,平衡向正反应方向移动,增大压强,平衡向正反应方向移动,增加了C的物质的量,物质C的质量分数增大,故B、D正确、A、C错误;
故选BD.
点评 本题考查压强对化学平衡的影响,为高频考点,侧重考查学生的分析能力,题目难度中等,本题注意从等效平衡的角度分析.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 28g N2所含原子数为NA | B. | 0.5mol H2O所含原子数为1.5NA | ||
| C. | 1mol H2O含有的水分子数目为NA | D. | 0.5NACl2分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑ | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-=Cu(OH) 2↓+SO42- | |
| D. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-=AgCl↓+NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p(甲)<p(乙)<p(丙) | B. | p(甲)>p(乙)>p(丙) | C. | p(甲)<p(丙)<p(乙) | D. | p(乙)>p(甲)>p(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28 mL | |
| C. | 常温常压下测得1 mol N2的质量为28 g | |
| D. | 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
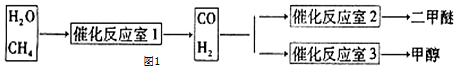

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①或② | B. | ②或④ | C. | ①或③ | D. | ③或④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构相同 | |
| C. | 元素Y 的简单气态氢化物的热稳定性比Z 的强 | |
| D. | 只含X、Y、Z三种元素的化合物,一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅳ:△H<0,T2>T1 | ||
| C. | 反应Ⅲ:可能是△H>0,T2>T1 | D. | 反应Ⅱ:△H<0,T1<T2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com