
| A. | 该混合溶液中一定含有Fe2+、NO3-、NH4+、SO42- | |
| B. | 白色沉淀甲一定是Al(OH)3 | |
| C. | 该混合溶液中肯定含有Fe2+、NH4+、CO32-、NO3- | |
| D. | 向该混合溶液中滴加酚酞试液后呈红色 |
分析 (1)第一份加入足量盐酸,产生气体在空气中变为红色,红色气体为NO2,则H+、Fe2+、NO3-发生氧化还原反应生成NO;根据离子共存可知,一定不存在CO32-;
(2)在(1)的溶液中逐滴滴加Ba(OH)2溶液至过量,产生白色沉淀,并有气体逸出,产生的气体为氨气,一定含NH4+;加过量Ba(OH)2生成的沉淀可能为氢氧化亚铁、氢氧化镁或硫酸钡,可能含有Mg2+、Fe2+、SO42-;
3)向(2)反应的溶液中通入适量CO2,有白色沉淀甲生成,该沉淀可能为碳酸钡或氢氧化铝沉淀;
由于阴离子只有SO42-、NO3-,且浓度均为0.1mol/L,已知含有的阳离子为:NH4+、Fe2+,已经满足溶液电中性,则溶液中不会存在其它阳离子,则白色沉淀甲一定不是氢氧化铝沉淀,据此进行解答.
解答 解:(1)第一份加入足量盐酸,产生气体在空气中变为红色,红色气体为NO2,则H+、Fe2+、NO3-发生氧化还原反应生成NO;根据离子共存可知,一定不存在CO32-;
(2)在(1)的溶液中逐滴滴加Ba(OH)2溶液至过量,产生白色沉淀,并有气体逸出,产生的气体为氨气,一定含NH4+;加过量Ba(OH)2生成的沉淀可能为氢氧化亚铁、氢氧化镁或硫酸钡,可能含有Mg2+、Fe2+、SO42-;
3)向(2)反应的溶液中通入适量CO2,有白色沉淀甲生成,该沉淀可能为碳酸钡或氢氧化铝沉淀;
由于阴离子只有SO42-、NO3-,且浓度均为0.1mol/L,已知含有的阳离子为:NH4+、Fe2+,已经满足溶液电中性,则溶液中不会存在其它阳离子,即:原溶液中存在的离子为:SO42-、NO3-、NH4+、Fe2+,
A.加盐酸不生成沉淀,则不含AlO2-,加NaOH沉淀不溶解则不含Al3+,与盐酸反应生成的无色气体不是二氧化碳,则不含CO32-,由电荷守恒可知不含Fe3+,故A正确;
B.根据分析可知,溶液中不存在铝离子,则白色沉淀一定为碳酸钡,故B错误;
C.由上述分析可知,一定含Fe2+、NH4+、SO42-、NO3-,一定不存在碳酸根离子,故C错误;
D.由上述分析可知,一定含Fe2+、NH4+、SO42-、NO3-,溶液显酸性,该混合溶液中滴加酚酞试液后为无色,故D错误;
故选A.
点评 本题考查物质或离子的检验,为高频考点,题目难度中等,把握离子之间的反应及反应现象推断离子为解答的关键,侧重分析与推断能力的考查,注意利用电话守恒分析铁离子为解答的难点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ′
′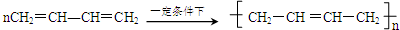 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3→NH3+HNO3 | B. | NH4NO3→O2+HNO3+H2O | ||
| C. | NH4NO3→N2+O2+H2O | D. | NH4NO3→N2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | a | b | c | d |
| 反应前的质量(g) | 6.4 | 3.2 | 4.0 | 2.8 |
| 反应后的质量(g) | 5.2 | X | 7.2 | 2.8 |
| A. | a和c是反应物 | B. | d一定是催化剂 | ||
| C. | X=2.0g | D. | 该反应是化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是SiO2 | |
| B. | 利用SiO2与碳反应制粗硅 | |
| C. | 常温下硅性质稳定,不与氯气、强酸、强碱溶液等起反应 | |
| D. | SiO2性质稳定,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa与足量O2反应,转移0.2nA个电子 | |
| B. | 1L0.1mol•L-1Na2S溶液中含有0.1nA个S2- | |
| C. | 常温下,44gCO2含有nA个C原子 | |
| D. | 标准状况下,22.4L的CCl4含有4nA个Cl原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com