
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
| ||
| 冰晶石 |
| ||
| 冰晶石 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届宁夏银川一中高三第三次模拟考试化学试卷(带解析) 题型:填空题
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |

查看答案和解析>>
科目:高中化学 来源:2014届黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同
B元素原子的核外p电子总数比s电子总数少1
C原子p轨道上成对电子数等于未成对电子数,且与A同周期
D元素的族序数与周期数的差为4,且不与A元素在同一周期
E位于周期表中第七列
F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子
(1)A的基态原子最外层有 种不同运动状态的电子,F位于 区。
(2)E2+的基态核外电子排布式为 ,AD4为 (填极性或非极性)分子。
(3)A、B、C三种元素的电负性由小到大的顺序是 (用元素符号表示),B和C两元素中,B的第一电离能较大的原因是 ,与AC2互为等电子体的分子的名称为 。(只写一种)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为 ;F的原子半径是 pm;(阿伏加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源:2014届河北省衡水市高二下学期期末考试化学试卷(解析版) 题型:填空题
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素原子的核外p电子总数比s电子总数少1
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期
C原子核外所有p轨道全满或半满
D元素的主族序数与周期数的差为4
E是前四周期中电负性最小的元素
F在周期表的第七列
⑴A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
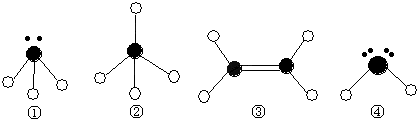
⑵某同学根据上述信息,所画的B电子排布图如图 ,违背了 原理。
,违背了 原理。
⑶F位于 族 区,其基态原子有 种运动状态。
⑷CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 ,检验E元素的方法是 。
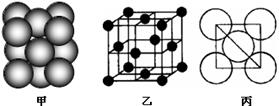
⑸若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年宁夏高三第三次模拟考试化学试卷(解析版) 题型:填空题
【化学一选修3:物质结构与性质】(15分)
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素原子的核外p电子总数比s电子总数少1 |
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
|
C原子核外所有p轨道全满或半满 |
|
D元素的主族序数与周期数的差为4 |
|
E是前四周期中电负性最小的元素 |
|
F在周期表的第七列 |
(1)A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形
(2)某同学根据上述信息,所画的B电子排布图如图
违背了 原理。
(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 .检验E元素的方法是
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com