
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)判断该有机物的化学式。
(2)若0.1 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。(已知:一个碳上接两个羟基是不稳定的)
【答案】 (1) C2H6O2 (2) HOCH2CH2OH
【解析】试题分析:(1)浓硫酸的质量增加10.8 g 因此水物质的量是10.8g÷18g/molo=0.6mol
其中氢原子的物质的量是1.2mol,氧原子的物质的量是0.6mol
通过灼热CuO 则根据反应式CuO+CO=Cu+CO2可知
CO的物质的量是3.2÷16=0.2mol
则CO2 物质的量的是17.6g÷44g/mol=0.4mol
其中由CO生成的CO2是0.2mol
原有机物燃烧生成的CO2是0.4mol-0.2mol=0.2mol
所以根据氧原子守恒可知
原有机物中氧原子的物质的量是0.6mol+0.2mol+0.2mol×2-0.4mol×2=0.4mol
所以根据原子守恒可知,有机物中C、H、O原子的个数之比是1:3:1
因此该有机物的化学式只能是C2H6O2
(2)4.6g金属钠的物质的量是0.2mol
这说明有机物中含有2个羟基HOCH2CH2OH
所以该有机物的结构简式是HOCH2CH2OH
考点:考查有机物化学式以及结构简式的判断和计算
点评:该题是高考中的常见考点之一,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是根据守恒法进行计算和讨论,有助于培养学生的逻辑思维能力和灵活应变能力。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
合成有机物G(C9H10O2)的过程如下,试回答下列有关问题。
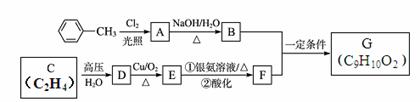
(1)A的分子式为 。
(2)C中的官能团的名称是 ;C转化为D的反应类型 。
(3)E转化为F的过程中酸化的目的是 。
(4)写出G与足量NaOH溶液反应的化学方程式: 。
(5)符合下列条件的G的同分异构体数目为 种:
①苯环上有3个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜。其中氢原子共有四种不同环境的所有物质的结构简式为 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,向100mLFeCl3溶液中通入a L的H2S气体恰好完全反应后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为( )
A.1 mol/ L B.1.5mol/L C. 2 mol/L D.以上答案均不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备溴苯可用如图所示的装置,填写下列空白:

(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,反应一段时间制的溴苯。溴苯是一种密度比水 (填”小”或”大”)的无色液体,在实验中因为 而显褐色。则三口烧瓶中发生反应的化学方程式为__ ___和_ __。
(2)D、E试管内出现的现象为_____________________________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C,可以看到的现象是____________________________________。
(4)三口烧瓶中的溴苯经过下列步骤分离提纯:
①向三口烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_ __。
(5) 经过上述分离操作后,粗溴苯中还含有的主要杂质为_____________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
根据元素周期表,填写下列空白:
(1)最活泼的非金属元素位于周期表中第 周期第 族、第 纵行。某元素B含有8个质子、10个中子,用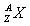 表示B原子的组成 ,
表示B原子的组成 ,
(2)在第三周期中,A、C两元素的原子序数之差为4,它们组成化合物AC的化学式为_____
(3)1mol某物质含有不同周期的三种元素各1mol,其核电荷总数为20mol,该物质的化学式为 ;它是 化合物(离子或共价)。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与Y同主族。下列说法正确的是( )
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.Y的气态简单氢化物的热稳定性比W的强
D.X的最高价氧化物对应水化物的酸性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个绝热的密闭容器中,发生反应:X(g)+3Y(g)  2Z(g) △H>0。进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
2Z(g) △H>0。进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A. 等压时,通入惰性气体,Z的物质的量不变
B. 等压时,通入Z气体,容器内温度改变
C. 等容时,通入惰性气体,反应速率不变
D. 等容时,通入Z气体,Y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是 。
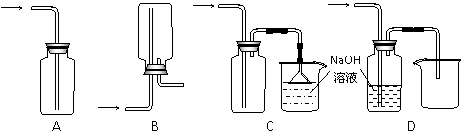

②已知氯水和SO2均具有漂白性,但两者同时使用漂白性却降低,用化学方程式解释原因_____________________________________________。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
_____________________________________________________。
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池的装置示意图(见下图甲),并作相应标注。


甲
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选
作阳极。
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙烯为原料合成化合物C的流程如图所示:
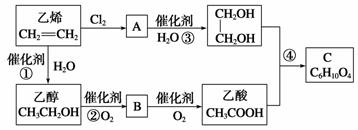
(1) B中含有的官能团名称为________________;A的结构简式:___________________。
(2)写出乙醇的同分异构体的结构简式:___________________________________。
(3)写出反应②和④的化学方程式:
②_____________________________________________________________________;
④_____________________________________________________________________。
(4)写出B与新制Cu(OH)2悬浊液反应的化学方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com