
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
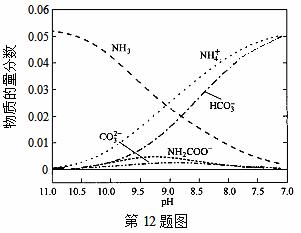
A.在pH=9.0时,c(NH4+)>c(HCO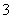 )>c(NH2COOˉ)>c(CO32-)
)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,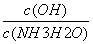 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
【答案】C
【解析】A、在pH=9.0时,作直线垂直于横坐标,从图上可直接看得出:c(NH4+)>c(HCO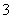 )>c(NH2COOˉ)>c(CO32-),A正确;B、根据电荷守恒可得:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ),B正确;C、
)>c(NH2COOˉ)>c(CO32-),A正确;B、根据电荷守恒可得:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ),B正确;C、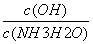 =
=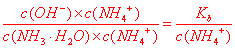 ,Kb不变,c(NH4+)不断增大,则比值不断减小,C不正确;D、从图上看,pH降低过程中,有含NH2COOˉ的中间产物生成,D正确。答案选C。
,Kb不变,c(NH4+)不断增大,则比值不断减小,C不正确;D、从图上看,pH降低过程中,有含NH2COOˉ的中间产物生成,D正确。答案选C。
【考点定位】本题主要是考查电解质溶液中离子浓度大小关系,电荷守恒关系,图像分析应用等。
【名师点晴】本题从知识上考查了电解质溶液。涉及弱电解质的电离和盐类的水解、离子浓度的大小比较、外加各类物质对电离平衡、水解平衡的影响。在比较离子浓度的大小关系时经常要用到物料守恒、电荷守恒、质子守恒这三大守恒关系。考察了学生对知识理解、综合运用能力,对离子浓度大小的比较的方法积三大守恒的掌握情况。这道高考题为一道中档题,创新性较强。


科目:高中化学 来源: 题型:
在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中,正确的是( )
A.原子半径:丙>乙>甲>丁
B.气态氢化物的稳定性:甲>丙
C.最高价氧化物对应水化物的酸性:丁>甲
D.乙和甲或乙和丁所能形成的化合物都是有毒物质
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中碰到的某些问题常常涉及到化学知识,下列叙述中不正确的是( )
A.变质的油脂有难闻的气味,是由于油脂与水发生了水解反应
B.家用消毒液发生器其原理是用石墨做电极电解饱和氯化钠溶液,制得有较强杀菌能力的消毒液
C.过氧乙酸可用于环境消毒,医用酒精可用于皮肤消毒, 其原因在于可以使病毒和细菌体内的蛋白质变性
其原因在于可以使病毒和细菌体内的蛋白质变性
D.家庭中可用铝合金容器长期存放菜、汤等食品
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产和生活中有着重要的应用,下列说法中不正确的是
A.明矾常做净水剂
B.与铜质水龙头连接处的钢质水管易发生腐蚀
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.金属钠着火时,可以使用泡沫灭火器来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
硅、硫、钠、铁、铝、铜等元素及其化合物在日常生活和生产中应用广泛,回答下列问题:
(1)Si元素在周期表中的位置是 , Na2S的电子式为 。
(2)H2S 、H2O 、SiO2、Na2O熔沸点由高到低的顺序为 。(用化学式表示)
(3)工业上常用氯化铁溶液腐蚀铜制电路板,反应的离子方程式是 。
要从上述腐蚀液中获得较纯的CuCl2溶液,需要将杂质 FeCl3和FeCl2除去,首先将Fe2+氧化成Fe3+,再向溶液中加入 (填化学式),最后过滤。
(4)在CuSO4溶液中通入过量的NH3,小心蒸发,最终得到[ Cu(NH3)4]SO4 晶体,晶体中含有的化学键除普通的共价键外,还含有 。
(5)将4.6g Na和8.1gAl组成的混合物投入到足量的水中,生成H2在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
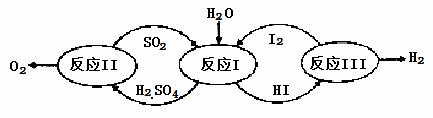
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
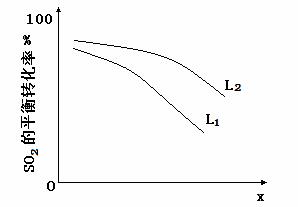
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A.-67.7 kJ·mol-1 B.-43.5 kJ·mol-1
C.+43.5 kJ·mol-1 D.+67.7 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com