
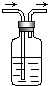
 ������ͼװ�ã����Գ�ȥ�����е����ʣ�д����ȥ���������е����������Լ�������ʽ���������ڵ�����Ϊ���ʣ���
������ͼװ�ã����Գ�ȥ�����е����ʣ�д����ȥ���������е����������Լ�������ʽ���������ڵ�����Ϊ���ʣ���


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 Ni��CO��4��g�� �÷�Ӧ�ġ�H
Ni��CO��4��g�� �÷�Ӧ�ġ�H
| 10 |
| 11 |
| ||
| ������ |
| ʯ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���㽭ʡ��һ�и����߿�ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ������
(13��)��.һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϡ�
(1)�������з�Ӧ���Խ�����ת��Ϊ���ȴ�99.9%�ĸߴ�����
Ni(s)��4CO(g) Ni(CO)4(g) �÷�Ӧ�Ħ�H �� 0 (ѡ�������������)��
Ni(CO)4(g) �÷�Ӧ�Ħ�H �� 0 (ѡ�������������)��
(2)�ڸ�����һ����̼�ɽ���������ԭΪ��������֪��
C(s)��O2(g)��CO2(g) ��H1����393.5 kJ��mol��1
CO2(g)��C(s)��2CO(g) ��H2��+ 172.5 kJ��mol��1
S(s)��O2(g)��SO2(g) ��H3����296.0 kJ��mol��1
��д��CO��SO2���Ȼ�ѧ����ʽ �� ��
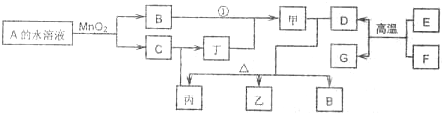
(3)��ͼ����ͼ��һ̼����ȼ�ϵ�أ�����COΪȼ�ϣ�һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ���ͼ�Ǵ�ͭ������װ��ͼ������ȼ�ϵ��Ϊ��Դ���д�ͭ�ľ���ʵ�顣�ش��������⣺
��д��A�������ĵ缫��Ӧʽ �� ��
��Ҫ��ȼ�ϵ��Ϊ��Դ���д�ͭ�ľ���ʵ�飬��B��Ӧ������ ��(���C����D��)������
�۵�����2.24 L(�����)COʱ����ͭ�缫�����ϼ���ͭ������ �� (������ڡ��������ڡ� ��С�ڡ�)6.4�ˡ�
��.(1)��֪Na2CrO4��Һ�ữʱ�����ķ�ӦΪ��2CrO42����2H�� Cr2O72����H2O����1L�ữ��������Һ�и�Ԫ�ص������ʵ���Ϊ0.55 mol��CrO42����10/11ת��ΪCr2O72������֪������ʱ�÷�Ӧ��ƽ�ⳣ��K��1014�������ữ��������Һ��pH�� �� ��
Cr2O72����H2O����1L�ữ��������Һ�и�Ԫ�ص������ʵ���Ϊ0.55 mol��CrO42����10/11ת��ΪCr2O72������֪������ʱ�÷�Ӧ��ƽ�ⳣ��K��1014�������ữ��������Һ��pH�� �� ��
(2)�����йع��ұ�����CrO42���ķ�ˮҪ����ѧ������ʹ��Ũ�Ƚ���5.0��10��7 mol��L��1���²����ŷš���CrO42���ķ�ˮ����ͨ�����������ַ�����
�ٳ���������������Ա�������BaCrO4������Ksp(BaCrO4)��1.2��10��10�ݣ��ټ�������������δ��������Ba2������������Ա��κ�ķ�ˮ��Ba2����Ũ��Ӧ��С�� �� mol��L��1��Ȼ���ٽ��к����������ܴﵽ�����ŷű���
�ڻ�ԭ����CrO42�� Cr3��
Cr3�� Cr(OH)3���ø÷�������10 m3 CrO42�������ʵ���Ũ��Ϊ1.0��10��3 mol��L��1�ķ�ˮ��������Ҫ�̷�(FeSO4��7H2O����Է�������Ϊ278) �� Kg(������λС��)��
Cr(OH)3���ø÷�������10 m3 CrO42�������ʵ���Ũ��Ϊ1.0��10��3 mol��L��1�ķ�ˮ��������Ҫ�̷�(FeSO4��7H2O����Է�������Ϊ278) �� Kg(������λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ���㽭ʡ�����߿�ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ������
(13��)��.һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϡ�
(1)�������з�Ӧ���Խ�����ת��Ϊ���ȴ�99.9%�ĸߴ�����
Ni(s)��4CO(g) Ni(CO)4(g) �÷�Ӧ�Ħ�H
�� 0 (ѡ�������������)��
Ni(CO)4(g) �÷�Ӧ�Ħ�H
�� 0 (ѡ�������������)��
(2)�ڸ�����һ����̼�ɽ���������ԭΪ��������֪��
C(s)��O2(g)��CO2(g) ��H1����393.5 kJ��mol��1
CO2(g)��C(s)��2CO(g) ��H2��+ 172.5 kJ��mol��1
S(s)��O2(g)��SO2(g) ��H3����296.0 kJ��mol��1
��д��CO��SO2���Ȼ�ѧ����ʽ �� ��
(3)��ͼ����ͼ��һ̼����ȼ�ϵ�أ�����COΪȼ�ϣ�һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ���ͼ�Ǵ�ͭ������װ��ͼ������ȼ�ϵ��Ϊ��Դ���д�ͭ�ľ���ʵ�顣�ش��������⣺
��д��A�������ĵ缫��Ӧʽ �� ��
��Ҫ��ȼ�ϵ��Ϊ��Դ���д�ͭ�ľ���ʵ�飬��B��Ӧ���� �� �� (���C����D��)������
�۵�����2.24 L(�����)COʱ����ͭ�缫�����ϼ���ͭ������ �� (������ڡ��������ڡ� ��С�ڡ�)6.4�ˡ�

��.(1)��֪Na2CrO4��Һ�ữʱ�����ķ�ӦΪ��2CrO42����2H��Cr2O72����H2O����1L�ữ��������Һ�и�Ԫ�ص������ʵ���Ϊ0.55 mol��CrO42����10/11ת��ΪCr2O72������֪������ʱ�÷�Ӧ��ƽ�ⳣ��K��1014�������ữ��������Һ��pH�� �� ��
(2)�����йع��ұ�����CrO42���ķ�ˮҪ����ѧ������ʹ��Ũ�Ƚ���5.0��10��7 mol��L��1���²����ŷš���CrO42���ķ�ˮ����ͨ�����������ַ�����
�ٳ���������������Ա�������BaCrO4������Ksp(BaCrO4)��1.2��10��10�ݣ��ټ�������������δ��������Ba2������������Ա��κ�ķ�ˮ��Ba2����Ũ��Ӧ��С�� �� mol��L��1��Ȼ���ٽ��к����������ܴﵽ�����ŷű���
�ڻ�ԭ����CrO42�� Cr3��
Cr3�� Cr(OH)3���ø÷�������10 m3 CrO42�������ʵ���Ũ��Ϊ1.0��10��3 mol��L��1�ķ�ˮ��������Ҫ�̷�(FeSO4��7H2O����Է�������Ϊ278) �� Kg(������λС��)��
Cr(OH)3���ø÷�������10 m3 CrO42�������ʵ���Ũ��Ϊ1.0��10��3 mol��L��1�ķ�ˮ��������Ҫ�̷�(FeSO4��7H2O����Է�������Ϊ278) �� Kg(������λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij������ȤС����ʵ��ķ�������̽����
ʵ��һ����������Cu��Fe��Mg�Ͳ�ͬŨ�ȵ����ᣨ0.5mol/L��2mol/L��18.4mol/L�������ʵ�鷽�����о�Ӱ�췴Ӧ���ʵ����ء�
��ͬѧ�о���ʵ�鱨�����±���
| ʵ �� �� �� | �� �� | �� �� |
| �ٷֱ�ȡ�������2 mol/L�������Թ��У� �ڷֱ�Ͷ���С����״��ͬ��Cu��Fe��Mg�� | ��Ӧ������ Mg>Fe>Cu | ��Ӧ�������Խ���ã� ��Ӧ����Խ�졣 |
 (1)��ͬѧ��ʵ��Ŀ���� ��
(1)��ͬѧ��ʵ��Ŀ���� ��
Ҫ�ó���ȷ��ʵ����ۣ�������Ƶ�ʵ�������� ��
(2)��ͬѧΪ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼװ�ý��ж���ʵ�顣��ɸ�ʵ��Ӧѡ�õ�ʵ��ҩƷ�����ǣ�����������ҩƷ����ѡ��
��
ʵ�����
��֪�� 2KMnO4+5H2C2O4+3H2SO4 = K2SO4+2MnSO4+8H2O+10CO2�����ڸ������������Һ�Ͳ�����Һ��Ӧʱ�����ֿ�ʼһ��ʱ�䣬��Ӧ���ʽ�������Һ��ɫ�����ԣ�������ͻȻ��ɫ����Ӧ�������Լӿ졣
(1)�������ʵ������ijͬѧ��ΪKMnO4��H2C2O4��Ӧ�Ƿ��ȷ�Ӧ��������Һ�¶����ߣ���Ӧ���ʼӿ졣��Ӱ�컯ѧ��Ӧ���ʵ����ؿ�����IJ��뻹������_______________��Ӱ�졣
(2)����ʵ��֤����IJ��룬�����Ը��������Һ��������Һ�Լ��⣬����Ҫѡ����Լ���������� ��
A������� B�������� C���Ȼ��� D��ˮ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com