
某温度下,将 通入KCH溶液中得到KCl、KClO和
通入KCH溶液中得到KCl、KClO和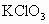 的混合溶液,经测定
的混合溶液,经测定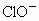 与
与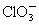 物质的量之比为1∶2,则反应中被氧化的
物质的量之比为1∶2,则反应中被氧化的 与被还原的
与被还原的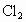 物质的量之比为
物质的量之比为
[ ]
科目:高中化学 来源: 题型:阅读理解
 (2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:
(2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市通州区高三年级上学期期末摸底考试化学试卷(解析版) 题型:填空题
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = – 1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH2 = – 566.0 kJ/mol
③ H2O(g) = H2O(1) ΔH3 = – 44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g)
+ 3H2(g) ΔH>0
CO(g)
+ 3H2(g) ΔH>0
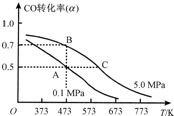
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则Tl ________T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =___________
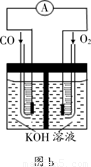
(3)某实验小组利用CO(g) 、 O2(g) 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com