

分析 卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入双氧水之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,可以根据溶解度受温度的影响情况来获得要制取的物质,
(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来检验已沉淀完全;根据加氧化镁后溶液的pH为4,可以沉淀的离子来判断滤渣的主要成分;
(3)温度、固体颗粒大小、物质的浓度等会影响反应速率;
(4)金属氧化物MgO能与酸反应产生盐和水,所以加入MgO的作用是调节溶液的pH,使杂质Fe3+形成沉淀完全除去.根据示意图可知滤渣的主要成分为BaSO4和Fe(OH)3;
(5)利用NaCl、Mg(ClO3)2的溶解度与温度的关系,将溶液蒸发浓缩结晶、趁热过滤、冷却结晶,最后过滤、洗涤,得到Mg(ClO3)2•6H2O;
(6)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;
②根据化学反应ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,根据各个质物之间的关系式可计算百分含量.
解答 解:(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,
故答案为:漏斗、玻璃棒、烧杯;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,
故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)影响化学反应速率的因素有:升高温度、将固体粉碎成细小的颗粒、增加物质的浓度等,因此加速卤块在KMnO4溶液中溶解的措施有:将卤块粉碎或加热等,
故答案为:将卤块粉碎或加热等;
(4)金属氧化物MgO能与酸反应产生盐和水.所以加入MgO的作用是调节溶液的pH,使杂质Fe3+形成沉淀完全除去.根据示意图可知滤渣的主要成分为BaSO4和Fe(OH)3,
故答案为:调节溶液的pH,使Fe3+沉淀完全;BaSO4和Fe(OH)3;
(5)利用NaCl、Mg(ClO3)2的溶解度与温度的关系将溶液蒸发浓缩、趁热过滤、冷却结晶,最后过滤、洗涤,就得到Mg(ClO3)2•6H2O,
故答案为:蒸发浓缩;冷却结晶;
(6)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,氯酸根离子的物质的量为$\frac{1}{6}$×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:($\frac{1}{2}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.31%,
故答案为:78.31%.
点评 本题考查实验制备方案,涉及对操作的分析评价、物质的分离提纯、离子方程式书写、物质含量测定、氧化还原反应滴定等,是对学生综合能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 一氧化氮 | B. | 二氧化硫 | C. | 一氧化碳 | D. | 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Al、S2- | B. | Fe3+、MnO4-、NO3- | C. | Cl2、HClO、Mg | D. | O2、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列电离方程式中,正确的是
A.Na2SO4 = 2 Na+ + SO4-2 B.Ba(OH)2 =Ba2+ +OH2-
C.H2CO3 =H+ +HCO3- D.Al2(SO4)3 =2Al3+ + 3SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:计算题
现有4g氢氧化钠恰好与100ml的盐酸完全反应,试计算(写计算过程)
(1)氢氧化钠的物质的量
(2)钠离子的数目
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
实验中的下列操作正确的是
A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为不浪费,又把过量的试剂倒入试剂瓶中
B. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
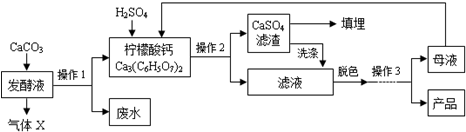
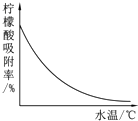 柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:
柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业.下图是两种不同方法制备一水柠檬酸晶体(C6H8O7•H2O)的工艺流程图.回答相关问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com