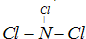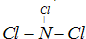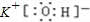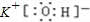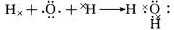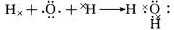现有A、B、C、D、E、F六种物质,已知它们的阳离子有:H+、K+、NH4+、Ca2+、Ba2+、Al3+,阴离子有:OH-、Cl-、ClO-、NO3-、CO32-、SO42-.将上述六种物质溶于水均配成0.1mol/L溶液,进行如下实验.
①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C.
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失.
③向F中加入A有无色气体生成.
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体.
(1)根据以上信息,填写下列溶液中溶质的化学式.C______,E______;
(2)书写D与过量的E反应的离子方程式______.
(3)书写实验④中反应的离子方程式______.
(4)向100mLA溶液中慢慢滴加入75mLF溶液和向75mLF溶液中慢慢滴加入100mLA溶液产生的气体体积之比约为______.
【答案】分析:①测得溶液A、C、D呈酸性,三种溶液为酸液或水解呈酸性的溶液,且酸性为A>D>C,则A为酸,溶液中含有大量的H+离子,H+离子与OH-、ClO-、CO32-、等离子不能大量共存,故A只能为盐酸;
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,可知D中有铝离子,而E中应有氢氧根,且含钡离子,E为氢氧化钡;
③F中加入A有无色气体生成,所以可推敲气体为二氧化碳,F中有碳酸根,和碳酸根离子不共存的离子不能存在;
④次氯酸根与氯离子还有氢离子结合生成水与氯气.
解答:解:①仅A、C、D三种溶液显酸性,且酸性强弱顺序为A>D>C,所以可推测A中有氢离子,且无碳酸根,次氯酸根,氢氧根;
②D与E反应生成白色沉淀,再加入过量的E沉淀量减少但不消失,看到沉淀量减少但不消失,很明了的就可知D有铝离子,而且D显酸性,所以D含硫酸根离子,D为硫酸铝,而E中应有氢氧根,且含钡离子,E为氢氧化钡;
③向F中加入A有无色气体生成,所以可推敲气体为二氧化碳,F中有碳酸根,且不含H+、Ca2+、Ba2+、Al3+;
④B的浓溶液与A的浓溶液混合产生有色且有刺激性气体,有色且有刺激性气体比较常见的第一反应就是氯气,且正好这又有次氯酸根和氯离子,可想到是次氯酸根与氯离子还有氢离子结合生成水与氯气,所以可知A是盐酸,而B中有次氯酸根,因为C呈酸性,所以它的阳离子为弱碱的阳离子,所以C中有铵根离子和硝酸根离子,所以C为硝酸铵,因为B和F都可溶,所以F为碳酸钾,B为次氯酸钙.
(1)根据上述推断结果可以知道:C为NH4NO3,E为Ba(OH)2,故答案为:NH4NO3;Ba(OH)2;
(2)硫酸铝和过量的氢氧化钡反应的离子方程式为:2Al3++3SO42-+8OH-+3Ba2+=2AlO2-+3BaSO4↓+4H2O,
故答案为:2Al3++3SO42-+8OH-+3Ba2+=2AlO2-+3BaSO4↓+4H2O;
(3)次氯酸钙和浓盐酸混合后发生反应会生成氯气,即Cl-+ClO-+2H+=Cl2↑+H2O,
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
(4)向100mLHCl溶液中慢慢滴加入75mL碳酸钾溶液,发生反应HCl+K2CO3=KHCO3+KCl,KHCO3+HCl=KCl+H2O+CO2↑,
盐酸和碳酸钾以及生成二氧化碳之间量的关系:75 75 75 25 25 25
向75mL碳酸钠溶液中慢慢滴加入100mL盐酸溶液,发生反应:K2CO3+2HCl=2KCl+H2O+CO2↑,
消耗盐酸和碳酸钾以及生成二氧化碳之间量的关系 50 100 50
从上面两种反应情况可以看出:产生的气体体积之比约为2:1.
故答案为:2:1.
点评:本题考查物质的推断,题目较难,注意从物质的性质以及反应现象推断.



 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.