
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| | 酸 | 实验结果 |
| a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
| b | 稀硫酸 | 加热也不发生反应 |
| c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
| d | 稀硝酸 | 微热发生反应,产生无色气体 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:计算题
某金属M的氢氧化物的水合晶体[M(OH)2?xH2O]与Na2CO3混合物共36.800g,加入足量的水后,生成MCO3的白色沉淀,将沉淀滤出,洗净烘干,其质量为9.850g。
47. 将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体_______mol。
48.滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况),滤液中OH?的物质的量为_______mol。
49.M的相对原子质量为_________;试通过计算确定M(OH)2?xH2O中x的值:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)【化学——化学与技术】
工业上以黄铁矿为原料,采用接触法生产硫酸。请回答下列问题:
(1)煅烧黄铁矿的设备名称是__________,进料前必须将黄铁矿粉碎,目的是________。所得炉渣的用途有__________________________(填一种用途)。
(2)进入接触室前的气体必须经过净化处理,目的是防止________________________________。
(3)生产过程中,吸收三氧化硫常用的物质是_____________________________。
(4)温度变化与二氧化硫转化率的变化关系可用下图中的曲线______(填“a”或“b”)表示。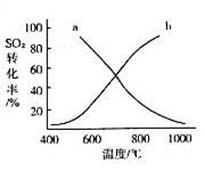
(5)工业上常用熟石灰和硫酸处理、回收尾气中的有害气体。反应的化学方程式为:
________________________________、_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
甲方案:如图所示。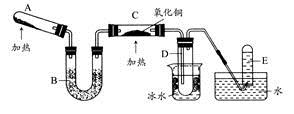
乙方案:如图所示。
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是 。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论) 。
(3)写出C中发生反应的化学方程式 。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理: 。E装置里盛装的药品是 。
(5)能证明氨气具有还原性的实验现象 。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有 ,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题: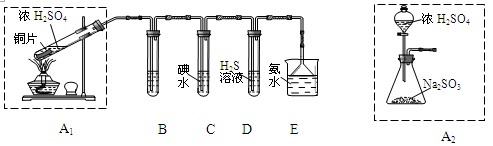
①装置A1中发生反应的化学方程式为 ;
②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质;
③装置C中反应的离子方程式为 ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点) 、 ;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。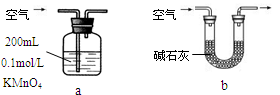
①你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ;
②你认为哪个装置不可行(填序号) ,说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用下述装置制取氯气,并用氯气进行下列实验。 回答下列问题: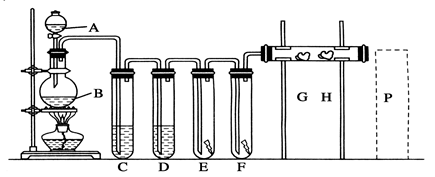
(1)A、B两仪器的名称:A_________________,B________________。
(2)洗气装置C是为了除去Cl2中的HCl气体,应放入的试剂是________________,D中浓H2SO4的作用是________________。
(3)E中为红色干布条,F中为红色湿布条,可看到有色布条褪色的是 _______。(填E或F)
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______________。
H是浸有NaBr溶液的棉花球,H处反应的离子方程式是___________________________________________。
(5)P处为尾气吸收装置, 写出实验室利用烧碱溶液吸取Cl2的离子方程式: ___________________。
(6)B中发生反应的化学方程式为_______________________ ,若实验中使用12 mol·L-1的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,试分析可能存在的原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。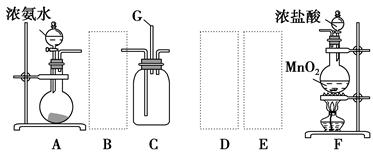
请回答下列问题:
(1)装置F中发生反应的离子方程式: 。
(2)装置A中的烧瓶内固体可选用 (选填以下选项的代号)。
A.碱石灰
B.生石灰
C.二氧化硅
D.五氧化二磷
E.烧碱
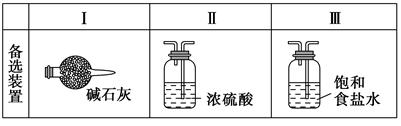
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D ,E 。(均填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵: 。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理? 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
单晶硅是信息产业中重要的基础材料。通常用焦炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。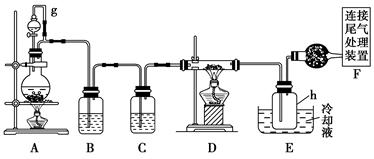
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
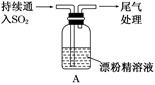 | i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色;iii.稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com