
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 硫酸 | 纯碱 | 石灰石 | 水 |
| B | 盐酸 | 烧碱 | 纯碱 | 生石灰 |
| C | 碳酸 | 胆矾 | 熟石灰 | 干冰 |
| D | 干冰 | 苛性钾 | 食盐 | 石灰石 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、Zn2+、Fe3+、Cu |
| B、Cu2+、Fe3+、Zn |
| C、Zn2+、Cu2+、Fe2+、Fe |
| D、Zn2+、Fe2+、Cu2+、Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铍是两性氢氧化物 |
| B、B、Si的电负性数值相似 |
| C、Li和Mg的原子半径相近,且核外电子排布相近 |
| D、铍与盐酸或氢氧化钠溶液反应均能产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子云是笼罩在原子核外的云雾 |
| B、下列电子排布式:1s22s12p1是某原子基态的排布式 |
| C、任何能层中的d能级的轨道数都为5 |
| D、[Ar]3d64s2表示的是Fe原子的电子排布式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,543.4g |
| C、1000mL,572g |
| D、500mL,286g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、质量数为35的氯原子:
| ||
B、BaSO4的电离方程式:BaSO4=Ba2++S
| ||
| C、乙烯的结构简式:C2H4 | ||
D、氯原子结构示意图: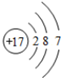 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com