

分析 (1)根据热化学方程式和盖斯定律计算得到反应焓变;先写出负极的电极反应,然后根据正极的电极反应=总反应-正极的电极反应;
(2)①根据氯化硅水解生成原硅酸和氯化氢;
②根据难溶物的溶度积来计算,若加钡矿粉调节pH=3时,C(H+)=1.0×10-3mol/L,C(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-3}}$mol/L=1.0×10-11mol/L,根据氢氧化铁的溶度积Ksp[Fe(OH)3]=4.0×10-38,计算得到离子浓度;
③第②步过滤后,需要调节溶液的pH=12.5,目的是沉淀镁离子;
④根据外界条件浓度对平衡的影响分析,Mg(OH)2(s)存在的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3•H2O,使平衡向正反应方向移动;
解答 解:(1)①Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H1=-601.8kJ/mol
②Mg(s)=Mg(g)△H2=+75kJ/mol
③Si(s)+O2(g)=SiO2(s)△H3=-859.4kJ/mol
依据盖斯定律②+③-①×2得到:2MgO(s)+Si(s)=SiO2(s)+2Mg(g)△H=+494.2kJ/mol;
电池总反应是:Mg+2NiOOH+2H2O═Mg(OH)2+2Ni(OH)2,负极的电极反应:Mg-2e-+2H2O═Mg(OH)2+2H+,正极的电极反应为:NiOOH+H2O+e-=Ni(OH)2+OH-;
故答案为:+494.2kJ/mol;NiOOH+H2O+e-=Ni(OH)2+OH-;
(2)①氯化硅水解生成原硅酸和氯化氢,水解方程式为:SiCl4+4H2O=H4SiO4↓+4HCl或SiCl4 +3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl或SiCl4 +3H2O=H2SiO3↓+4HCl;
②若加钡矿粉调节pH=3时,C(H+)=1.0×10-3mol/L,C(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-3}}$mol/L=1.0×10-11mol/L,根据氢氧化铁的溶度积Ksp[Fe(OH)3]=4.0×10-38,可知C(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1.0×1{0}^{-11})^{3}}$mol/L=4.0×10-5mol/L,故答案为:4.0×10-5mol/L;
③第②步过滤后,需要调节溶液的pH=12.5,目的是沉淀镁离子,使镁离子全部转化为氢氧化镁沉淀,
故答案为:使镁离子转化为氢氧化镁沉淀;
④Mg(OH)2(s)存在的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3•H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解,
故答案为:Mg(OH)2(s)在溶液中存在的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3•H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解.
点评 本题考查了物质制备流程分析判断,物质性质的应用,沉淀形成条件、平衡移动等以及盖斯定律应用、电极反应的书写,题目难度中等.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:解答题

 Ⅱ
Ⅱ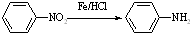 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; +2NaOH→
+2NaOH→ +HCOONa+H2O.
+HCOONa+H2O.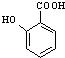 有多种同分异构体,其中含符合下列条件的共有2种.
有多种同分异构体,其中含符合下列条件的共有2种. 的过程.
的过程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可使①②③④反应速率均加快 | |
| B. | △H3=-110.5kJ.mol-1,△H4=+172.5kJ.mol-1 | |
| C. | 反应①②③④均属于化合反应、氧化还原反应 | |
| D. | CO的燃烧热是566.0kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .B与乙醇发生酯化反应生成X的化学方程式为
.B与乙醇发生酯化反应生成X的化学方程式为 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.
 经过几步有机反应制得,其中最佳的次序是:a.
经过几步有机反应制得,其中最佳的次序是:a.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )及其盐广泛应用于食品、医药、化工等领域.有一种制备乳酸方法如下:
)及其盐广泛应用于食品、医药、化工等领域.有一种制备乳酸方法如下:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠与浓硫酸混合加热:H2SO4+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+Cl2↑+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH═2 Al(OH)3↓+3BaSO4↓ | |
| C. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | 还原性 I2>Cl2 | ||
| C. | 非金属性Cl>I | D. | 氧化性 I2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠固体保存在配有玻璃塞的细口瓶中 | |
| B. | 将SO2通入品红溶液或KMnO4酸性溶液均能使它们褪色,均可证明SO2有漂白性 | |
| C. | 不能在石英坩埚中熔化氢氧化钠 | |
| D. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com