
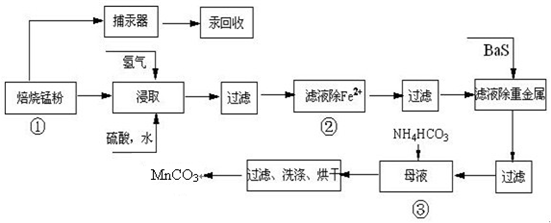
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | ______ |
| 步骤2:将pH调到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
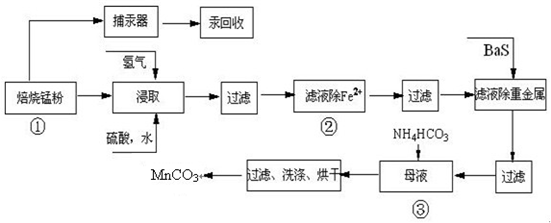
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | 2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe2++H2O2+2H+=2Fe3++2H2O |
| 步骤2:将pH调到 3.7~8.6 3.7~8.6 ,使Fe3+沉淀完全 |
Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中, 加入硝酸酸化的硝酸银溶液 加入硝酸酸化的硝酸银溶液 |
有白色沉淀产生 有白色沉淀产生 |
含有Cl- |
| 2.检验NH4+ | 取少许滤液于试管中, 加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 |
石蕊试纸变蓝色 石蕊试纸变蓝色 |
含有NH4+ |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源:梅州一模 题型:问答题
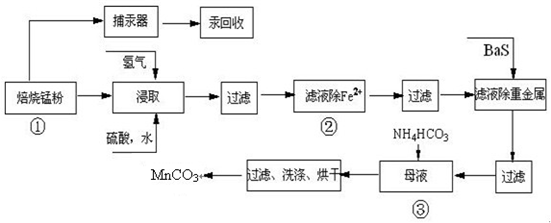
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | ______ |
| 步骤2:将pH调到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源:2010年广东省梅州市高考化学一模试卷(解析版) 题型:解答题
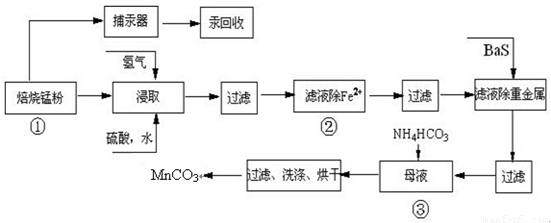
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | ______ |
| 步骤2:将pH调到______,使Fe3+沉淀完全 | Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com