
分析 (1)根据元素的化合价处于中间价态,既能升高,又能降低,既有氧化性又有还原性;
(2)根据透明的红褐色是胶体,胶体的粒子直径1nm<d<100nm;
(3)FeCl3溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+; 滴入KSCN溶液呈红色,存在三价铁离子;沉淀43.05g是氯化银,物质的量是0.3mol;
(4)检验的Fe2+方法;
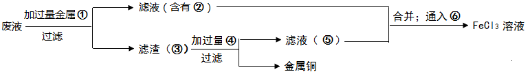
(5)A、根据图示进行推断,金属是铁;
B、亚铁离子氧化成三价铁离子.
解答 解:(1)因元素的化合价处于中间价态时,既能升高,又能降低,既有氧化性又有还原性,故答案为:C;
(2)因透明的红褐色是胶体,胶体的粒子直径1nm<d<100nm,故答案为:1~100;
(3)FeCl3溶液与铜反应的离子方程式是:2Fe3++Cu═2Fe2++Cu2+;由于滴入KSCN溶液呈红色,证明溶液中Fe3+有剩余,溶液中含有的金属阳离子是:Fe3+Fe2+Cu2+;
43.05g沉淀是氯化银,物质的量为0.3mol,溶液中c(Cl-)=$\frac{0.3mol}{0.05L}$=6.0mol/L;
故答案为:2Fe3++Cu═2Fe2++Cu2+; Fe3+、Fe2+、Cu2+;6.0;
(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,故A错误;
B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;故B正确;
C、试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有亚铁离子,故C错误;
故选B;
(5)A、制取的是氯化铁溶液,金属①是铁;滤液②是氯化亚铁溶液;加入的铁过量,滤渣③是铁和铜;制取的是氯化铁,溶解铁,④加入应该是盐酸;
故答案为:Fe;FeCl2;Fe Cu;
B、⑥是将亚铁离子氧化成三价铁离子,反应方程式是:2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
点评 本题考查了铁及其化合物的性质,涉及的内容较多,注意分析题中提供的信息,根据所学知识写成反应的方程式,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加入Ba(OH)2溶液若有沉淀说明有CO32- | |
| B. | 加入盐酸若有能使澄清石灰水变浑浊的气体生成,说明含CO32- | |
| C. | 先加入BaCl2溶液,过滤.再在沉淀中加入盐酸,看能否产生使澄清石灰水变浑浊的无色无味气体 | |
| D. | 先加盐酸酸化,再加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO${\;}_{3}^{2-}$ | B. | NO${\;}_{3}^{-}$ | C. | OH- | D. | SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体带正电荷 | |
| B. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9-10-7m之间 | |
| C. | 把FeCl3饱和溶液滴入到沸腾的蒸馏水中,以制取Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体的电泳实验中,阴极区颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.| 化学键 | H-H | O=O | O-H |
| 键能(kJ•mol-1) | X | 496.4 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与O2反应,条件不同,产物不同 | |
| B. | 铝制餐具不能长期存放酸性食物,但可长期存放碱性食物 | |
| C. | 金属钠着火时,用细沙覆盖灭火 | |
| D. | 将金属钠投入FeCl3溶液中,生成红褐色沉淀,同时放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com