
| A. | 标准状况下,11.2LH2O所含分子数为0.5NA | |
| B. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 0.1molZn与含0.1molHCl的盐酸溶液充分反应,转移电子数目为0.2NA |
分析 A.常温常压下,水是液体,不能利用气体摩尔体积计算其物质的量;
B.n=c×V,不知道溶液的体积,无法计算其物质的量;
C.依据氧气和臭氧的混合物中含有的氧原子的质量计算出氧原子的物质的量及数目;
D.Zn在化合物中呈现+2价,据此判断即可.
解答 解:A.常温常压下,水是液体,不能利用气体摩尔体积计算其物质的量,即11.2L水的物质的量无法计算,故A错误;
B.n=c×V,不知道氯化钙溶液的体积,无法计算氯化钙溶液中氯化钙的物质的量,故B错误;
C.32g O2和O3含有的氧原子质量都为32g,含有的氧原子的物质的量都为2mol,氧原子数均为2NA,故C正确;
D.0.1molZn失去电子数是0.2mol,0.2molZn反应转移的电子数是0.4NA,故D错误,故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
下列各离子浓度的大小比较中正确的是
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大
B.0.2 mol•L-l NH4Cl 和 0.l mol•L -l Na
-l Na OH 溶液等体积混合后:
OH 溶液等体积混合后:
c(NH4+) > c (Cl―) > c (Na+) > c (OH-) >c (H+)
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:
c (Na+) +c(H+) = c (S2―) +c (HS―)+c (OH―)
D.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
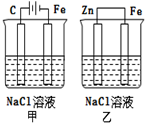
| A. | 甲装置是牺牲阳极的阴极保护法 | |
| B. | 乙装置是牺牲阳极的阴极保护法 | |
| C. | 一段时间后甲、乙装置中pH均增大 | |
| D. | 甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在NaAlO2溶液中通入过量CO2:AlO2-+4CO2+2H2O═Al3++4HCO3- | |
| B. | Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| C. | 用Fe(NO3)2溶液加入HCl溶液:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | FeBr2溶液通入少量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有NA 个CH3COO-的醋酸溶液中,H+数目略大于NA | |
| B. | 常温下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.5NA | |
| C. | 16.9 g BaO2固体中阴、阳离子总数为0.3NA | |
| D. | 含有1 mol Fe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
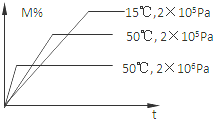 在密闭容器中进行反应:M(g)+N(g)?R(g)+2L,此反应符合下图关系,该反应是下列哪种情况( )
在密闭容器中进行反应:M(g)+N(g)?R(g)+2L,此反应符合下图关系,该反应是下列哪种情况( )| A. | 正反应吸热,L是固体或液体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L是固体或液体 | D. | 正反应放热,L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B是固体和C是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 乙烯可作为水果的催熟剂 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 使用漂白液时不可与酸性洁厕剂混用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com