
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:__________________。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填“>’’、“<’’或“ =’’)》
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH) 3]=6.0×10-31}
【答案】(1)Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(2)MOH![]() M++OH-;
M++OH-;
(3)①>;②NaHA溶液显碱性,说明HA-水解程度大于电离程度(1分);
(4)①1:6(2分)②6(2分)
【解析】
试题分析:(1)明矾净水是因为溶液中的铝离子水解成氢氧化铝胶体有吸附性,所以离子方程式为:A Al3+ + 3H2O![]() Al(OH)3 + 3H+。
Al(OH)3 + 3H+。
(2)二者的物质的量相等,恰好完全反应生成盐,溶液显酸性说明碱为弱碱,所以电离方程式为MOH![]() M+ + OH-。
M+ + OH-。
(3)①溶液显碱性,说明水解大于电离,所以水解出的H2A浓度大于电离出的A2-浓度。
②NaHA溶液显碱性,说明HA_的水解程度大于其电离程度。
(4)①每摩尔Cr2O72-反应过程中得到6摩尔电子,而每摩尔硫酸亚铁失去1摩尔电子,所以二者比例为1:6。
②根据Ksp[Cr(OH)3]=c((Cr3+)c(OH-)3,所以c(OH-)3=6.0×10-31/6.0×10-7=10-24,c(OH-)=10-8mol·L-1,则氢离子浓度=10-14/10-8=10-6mol·L-1,所以溶液的pH=6。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】今有X(g)+Y(g) ![]() 2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:
2Z(g);正反应放热。从反应开始经过t1后达到平衡状态,t2 时由于条件改变,平衡受到破坏,在t3时又达到平衡,据图回答:
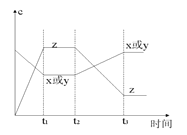
从t2→t3的曲线变化是由哪种条件引起的( )
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol·L-1Na2CO3溶液,下列操作正确的是( )
A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取10.6 g无水碳酸钠于烧杯中,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,它的性质或用途,其物理性质与NaCl极为相似.相关化学性质如图所示,下列说法不正确的是( )

A.NaNO2稳定性大于NH4NO2
B.NaNO2与N2H4反应中,NaNO2是氧化剂
C.可用KI-淀粉和食醋鉴别NaNO2和NaCl
D.分解NaN3盐每产生1molN2 转移6mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250 mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
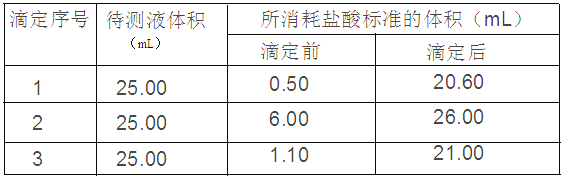
(1)用___________滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液。
(2)试样中NaOH的质量分数为______________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是________________。
Ⅲ.沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
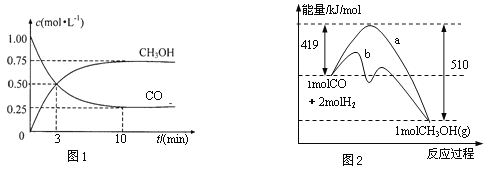
(1)图1是表示一定温度下,在体积为2 L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率 v(CO)=_____________;H2的平衡转化率为_______________。
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式:______________。
(3)该温度下,反应平衡常数K=______________(填数值)。
(4)恒容条件下,下列措施中能使反应体系中![]() 增大的措施有____________。
增大的措施有____________。
A.升高温度 B.充入He气 C.再充入2molH2 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.能与NaOH溶液反应的同分异构体共有6种
B.存在分子中含有六元环的同分异构体
C.既含有羟基又含有醛基的有5种
D.不存在含有2个羟基的同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com