
 为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是
为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② |
③NaOH ④ |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧Na2O |
⑨HCl ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 判断依据 | 反应中有沉淀生成或溶解 | 反应中有颜色变化 | 反应中有气体生成 |
| A、CO32----------------气体法 |
| B、SO42------------------沉淀法 |
| C、H+--------------------显色法 |
| D、Cl---------------------气体法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| B、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |
| C、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| D、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
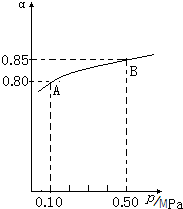 SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一.| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com