
用已知物质的量浓度的NaOH溶液测定未知物质的量
浓度的盐酸,其操作错误的是 ( )
A.酸式滴定管需用待测盐酸润洗 B.碱式滴定管不用标准碱液润洗
C.滴定过程中不能有液体从锥形瓶溅出 D.滴定结束,读数时要平视读数
科目:高中化学 来源: 题型:
某化学学习小组同学对实验室制取氨气和氨气的还原性等进行了以下探究,
请你参与并完成对有关问题的解答。
[资料获悉]
①氨气与CuO反应的化学方程式:3CuO+2NH3  3Cu+N2+3H2O
3Cu+N2+3H2O
②Cu2O粉末呈红色;Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+:Cu+ Cu+Cu2+。
Cu+Cu2+。
③在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。

[实验探究]
(1)A装置是氨气的发生装置,则实验前大试管中应加入的药品是 。
(2)甲同学认为该实验设计有一定的缺陷,A装置产生的氨气中含有水蒸气,影响了实验结论,应在A和B之间增加一个装有 (填药品名称)的干燥装置。
(3)利用改进后的装置进行实验,可观察到B装置中的现象为黑色固体变成红色,C 装置中的现象为 。
[交流讨论]
(4)乙同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O(氧化亚铜)。现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,用最简便的实验方法证明红色固体中是否含有Cu2O所要选用的试剂是 。
(5)丙同学认为可通过高温灼烧红色固体,并称量反应前后固体质量的变化来确定是否含有Cu2O。他先称干燥坩埚的质量为a g,再取红色固体置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,最后称得总质量为c g。若确认红色固体中只含有Cu,则经高温灼烧后得到的物质是 。
若确认红色固体中含有Cu2O,则a、b、c应符合数学关系为c< 。
[拓展延伸]
(6)丁同学认为利用上述实验设计改进后的装置还可测定Cu的相对原子质量,他是通过测定反应物CuO的质量和生成物H2O的质量来完成的。若实验测得完全反应的 CuO和生成的H2O的质量分别为m(CuO)、m(H2O),则据此计算Cu的相对原子质量
的代数式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
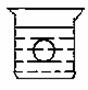
如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。试回答:
⑴此实验中,观察到的现象有:
① ,
② 。
⑵写出实验过程中反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通入乙烷和氧气,其电极反应式为:C2H6+18OH--14e - =2CO32-+12H2O 7H2O+7/2O2+14e -=14OH-,有关此电池的推断正确的是
A.通氧气的电极为负极
B.参加反应的氧气与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度不变
D.电解质溶液中CO32-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能在指定环境中大量共存的是 ( )
A.在c(H+)=10-10 mol/L的溶液中 Al3+ 、NH 、Cl- 、NO
、Cl- 、NO
B.pH值为1的溶液 Fe2+、Na+ 、SO42-、NO
C.水电离出来的c(H+)=10-12mol/L的溶液 K+、HCO3-、Cl-、ClO-
D.pH值为13的溶液 K+、CO 、Na+、AlO2-
、Na+、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
LiFePO4电池具有稳定性高、安全、环保等优点,可用于电动汽车。电池反应为:
FePO4+Li 
 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法错误的是 ( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法错误的是 ( )
A.可加入硫酸以提高电解质的导电性 B.放电时电池内部Li+向正极移动
C.充电过程中,电池正极材料的质量减少 D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为____,B池为____。
(2)锌极为____极,电极反应式为__ _;
铜极为_____极,电极反应式为__________ ;

石墨棒C1为____极,电极反应式为____ ;
石墨棒C2附近发生的实验现象为________ 。
(3)当C2极析出224 mL气体(标准状况下),锌的质量变化为(增加或减少)__________g。
CuSO4溶液的质量变化为(增加或减少)__________g。
(4)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
用等体积的的 1 mol·L-1的BaCl2溶液,可使相同体积的Na2SO4 、Fe2(SO4)3 、KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为 ( )
A.1︰3︰2 B.6︰2︰3 C.1︰1︰1 D.3︰1︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.Fe在少量Cl2中燃烧生成FeCl2,在足量Cl2中燃烧生成FeCl3
B.在空气中用小火慢慢加热蒸干硫酸亚铁溶液,不会得到纯净的硫酸亚铁固体,
C.鉴别Fe2+和Fe3+,可以使用酸性KMnO4溶液 ,也可使用KI淀粉溶液
D.Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com