
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O,
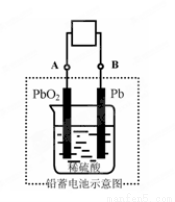
则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:填空题
(8分)氨在国民经济中占有重要地位。
(1)已知合成氨反应:N2(g)+3H2(g) 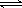 2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是 (填写编号)
2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是 (填写编号)
① 升高温度; ② 缩小容器体积(加压); ③ 选择高效催化剂; ④ 在恒容条件下,再充入合成氨的原料气(N2、H2); ⑤在恒容条件下,再充入原平衡的混合气;⑥在恒容条件下,分离出氨气。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
T / ℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
ΔH(填“>”、“<”或“=”) 0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)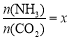 ,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是 。

③上图中的B点处,NH3的平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
已知:SO2(g)+ O2(g)
O2(g) 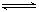 SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是
SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是
A.5 min内用O2表示的反应速率为0.12 mol/(L·min)
B.该反应的平衡常数数值为7.5
C.SO2的平衡转化率为60%
D.加入催化剂,可使ΔH变小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:填空题
(14分)碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx mL,理由是 。
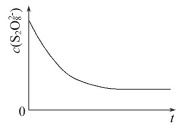
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s) ΔH
2LiI(s) ΔH
已知: ①4Li(s)+O2(g) 2Li2O(s) ΔH1
2Li2O(s) ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s) ΔH2
2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
已知:①H2O(g)=H2O(l) △H1=-Q1 kJ·mol—1;
②C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ·mol—1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ·mol—1
若使23g酒精液体完全燃烧,生成稳定的氧化物,最后恢复到室温,则放出的热量是多少kJ( )
A.Q1+ Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5 Q1-1.5 Q2+0.5Q3 D.1.5Q1-0.5Q2+0.5Q3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
关于下列各装置图的叙述中,不正确的是
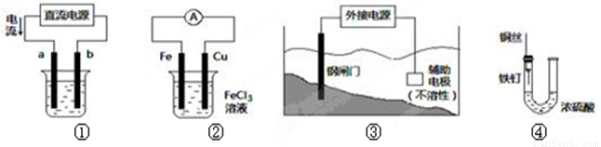
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,使之能够实现如图转化,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为
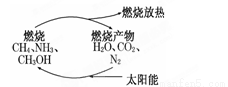
A.化学能 B.热能
C.生物能 D.电能
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol -1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.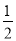 H2SO4(aq)+
H2SO4(aq)+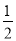 Ba(OH)2(aq)=
Ba(OH)2(aq)=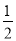 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(B)试卷(解析版) 题型:选择题
除去某物质里混有的少量杂质,下列做法中不正确的是(括号内的物质为杂质)
A.KNO3溶液(AgNO3):加足量KCl溶液后过滤.
B.NaCl溶液(Na2CO3):加足量盐酸后加热.
C.KNO3固体(NaCl): 溶解后加热蒸发得浓溶液,降温结晶后过滤.
D.NaCl溶液(BaCl2): 加过量Na2CO3溶液,过滤,再加适量盐酸并加热.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com