
| A. | 可以利用该反应检验Mn2+ | |
| B. | 配平后的系数为2、5、8、2、10、16 | |
| C. | 该反应中酸性介质不能为盐酸 | |
| D. | 若有0.1mol还原产物生成,则转移电子0.5mol |
分析 2Mn2++5S2O82-+8X=2MnO42-+10SO42-+16H+中,Mn元素的化合价升高,S元素的化合价降低,由电荷守恒可知,X为中性物质,结合原子守恒可知X为H2O,以此来解答.
解答 解:A、由于MnO4-在溶液中显紫红色,所以可以利用该反应检验Mn2+,故A正确;
B、根据方程式可知,Mn元素的化合价从+2价升高到+7价,失去5个电子;S元素的化合价从+7价降低到+6价,得到1个电子,所以根据电子的得失守恒可知,故B正确;
C、酸性高锰酸钾溶液能氧化盐酸,生成氯气,所以该反应的介质不能用盐酸,故C正确;
D、由反应可知,反应中Mn元素化合价由+2价升高到+7价,变化5价,则有0.1mol氧化产物生成,则转移0.5mol电子,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,选项B为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O溶液的c(OH-)<NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将等体积的氢氧化钠和氨水溶液加水稀释相同倍数,NaOH溶液的pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. | 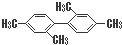 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 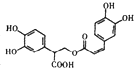 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x>a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x>b | 电极附近出现黄色,无气泡产生 | 有Fe3+,无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+,无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x>c | 无明显变化 | 有Cl2 |
| Ⅴ | c<x<b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红热的铁丝在氯气中燃烧产生棕色的雾 | |
| B. | 含有氯元素的物质都呈黄绿色,均有毒 | |
| C. | 氢气在氯气中燃烧时,火焰显淡蓝色 | |
| D. | 氯水中滴入硝酸银溶液和稀硝酸后,产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com