
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.升高温度,若W的体积分数减小,则此反应ΔH>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是
K=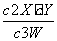
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
Ⅰ. (1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g) ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g) ΔH=-221 kJ·mol-1;
(g)===2CO(g) ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是________,NO分子中化学键的键能为________kJ·m ol-1。
ol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
Ⅱ.
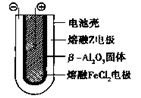
 熔融状态下,
熔融状态下, 钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2  Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为_______ _______________;
_______________;
充电时,________(写物质名称)电极接电源的负极;该电池的电解质为____ __
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组
是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)
D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案不能达到实验目的的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol·L-1NaOH溶液中先加入3滴1 mol·L-1MgCl2溶液,再加入3滴 1 mol·L-1FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下,反应SO2(g)+NO2(g)  SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是( )
SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是( )
A.该温度下反应2SO2(g)+2NO2(g)  2SO3(g)+2NO(g)的平衡常数为0.48
2SO3(g)+2NO(g)的平衡常数为0.48
B.若该反应ΔH<0,则升高温度化学平衡常数K减小
C.若升高温度,逆反应速率减小
D. 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=________;ΔH________0(填“>”“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭 容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 s内A的平衡反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________mol·L-1;C的物质的量为________mol。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为________;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率________(填“增大”“减小”或“不变”)。
(4)判断该反应是否达到平衡的依据为________(填正确选项的字母)。
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(5)1 200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
LED系列产品是被看好的一类节能新产品, 下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是 ( )
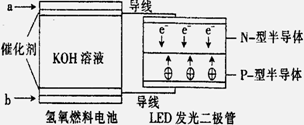
A.a处通入氢气,发生了还原反应: H2-2e-+2OH-=2H2O
B.b处通入氧气,为电池的正极
C.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替
D.P-型半导体连接的是电池负极
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成UV高级油墨的主要成分的路线图如下:
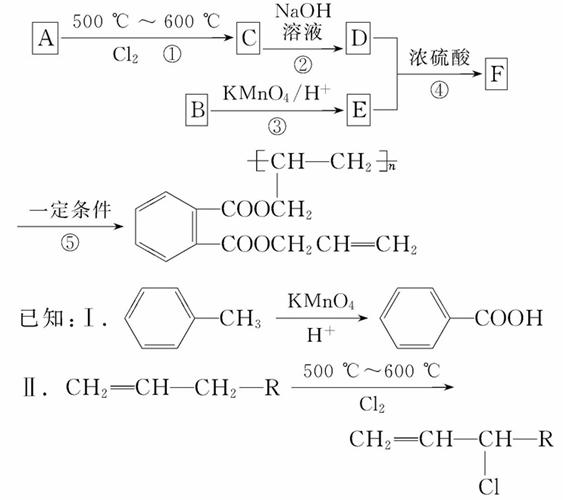
请回答:
(1)A的结构简式为___________________________________________。
(2)下列有关D的说法,正确的是_______(填序号)。
A.能使紫色石蕊试液变红
B.能发生缩聚反应
C.能发生取代反应
D.能发生加成反应
(3)F的官能团有_______种(不含苯环)。1 mol F与氢氧化钠溶液共热,最多能消耗_______mol NaOH。
(4)反应②的化学方程式为_______________________________________。
(5)E有多种同分异构体,写出同时符合以下条件的同分异构体的结构简式_______________________________________。
①与NaHCO3反应能生成CO2气体
②与新制氢氧化铜悬浊液共热能生成红色沉淀
③苯环上的一氯代物只有2种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碱金属元素和卤素的说法中,错误的是( )
A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.溴单质与水的反应比氯单质与水的反应更剧烈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com