
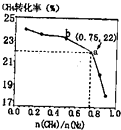
 CH4����N2��һ����������ֱ�����ɰ���3CH4��g��+2N2��g��$?_{����}^{700��}$3C��s��+4NH3��g����H��0��700��ʱ��$\frac{n��C{H}_{4}��}{n��{N}_{2}��}$��CH4��ƽ��ת���ʵĹ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ�������
CH4����N2��һ����������ֱ�����ɰ���3CH4��g��+2N2��g��$?_{����}^{700��}$3C��s��+4NH3��g����H��0��700��ʱ��$\frac{n��C{H}_{4}��}{n��{N}_{2}��}$��CH4��ƽ��ת���ʵĹ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ�������| A�� | $\frac{n��C{H}_{4}��}{n��{N}_{2}��}$Խ��CH4��ת����Խ�� | |
| B�� | $\frac{n��C{H}_{4}��}{n��{N}_{2}��}$�벻��ʱ�����£�NH3������������С | |
| C�� | b���Ӧ��ƽ�ⳣ����a��Ĵ� | |
| D�� | a���Ӧ��NH3���������ԼΪ13% |
���� ��ͼ��֪��������Ϊ�����ת���ʣ�������Ϊ$\frac{n��CH{\;}_{4}��}{n��N{\;}_{2}��}$��$\frac{n��CH{\;}_{4}��}{n��N{\;}_{2}��}$Խ�����ת����ԽС��ƽ�������ƶ�ʱ�������������������ƽ�ⳣ��ֻ���¶��йأ�������a�����ת����Ϊ22%���㰱��������������Դ������
��� �⣺A����ͼ����CH4��ת������$\frac{n��CH{\;}_{4}��}{n��N{\;}_{2}��}$����������ͣ���A����
B����H��0���÷�Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ���NH3���������������B����
C��ab������¶���ͬ��ƽ�ⳣ��ֻ���¶��йأ���ƽ�ⳣ�����䣬��C����
D��a�����ת����Ϊ22%��$\frac{n��CH{\;}_{4}��}{n��N{\;}_{2}��}$=0.75���������Ϊ3mol������Ϊ4mol��
3CH4��g��+2N2��g�� 3C��s��+4NH3��g����H��0
3C��s��+4NH3��g����H��0
��ʼ 3 4 0
ת�� 0.66 0.44 0.88
ƽ�� 2.34 3.56 0.88
��NH3���������ԼΪ$\frac{0.88}{2.34+3.56+0.88}$��100%=13%����D��ȷ��
��ѡD��
���� ���⿼�黯ѧƽ��ͼ���㣬Ϊ��Ƶ���㣬����ͼ�����ݺ�����ĺ��塢Ӱ��ƽ������ؼ�ƽ�ⳣ������ѧƽ�����η������Ϊ���Ĺؼ���ע�ظ߿���Ƶ����Ŀ��飬��Ŀ�Ѷ��еȣ�


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -69.4kJ•mol-1 | B�� | -45.2kJ•mol-1 | C�� | +69.4kJ•mol-1 | D�� | +45.2kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ӻ�ˮ������Ĺؼ���Ӧ�ǣ�Cl2+2Br-�T2Cl-+Br2 | |
| B�� | ��ˮ�к��м�Ԫ�أ�ֻ�辭�������仯�Ϳ��Եõ��ص��� | |
| C�� | ��ˮ�е�Na+��Cl-�ᾧ��NaCl�Ĺ��̣��γ��˻�ѧ�� | |
| D�� | �Ӻ�ˮ�п��Եõ��Ȼ�þ���پ��������ƽ���þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Һ�У�Na+��H+��Cl-��NO3-���Դ������� | |
| B�� | ��������ˮ��Ӧ�����ӷ���ʽ��Fe2++Cl2=Fe3++2Cl- | |
| C�� | ����NaOH��Һ��Fe2+�պó�����ȫ�����ӷ���ʽ��Fe2++2OH-=Fe��OH��2�� | |
| D�� | ����Ũ�ȹ�ϵ��c��SO42-��=c��NH4+ ����c��Fe2+ ����c��H+ ����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | W��X��Y�γɵļ����ӣ���뾶��С��ϵΪW��X��Y | |
| B�� | M��WԪ���γɵļ��⻯����ȶ��ԣ�W��M | |
| C�� | X��ͬ�����н�������ǿ��Ԫ�� | |
| D�� | Z������������Ӧ��ˮ�����Ũ��Һ����Y�ĵ����ڳ����¾��ҷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
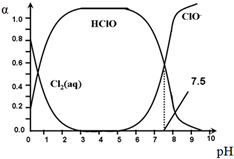 ��������ˮ�����г�����ɱ��������HClO��ɱ��������ClO-ǿ��25��ʱ����-��ˮ��ϵ�д�������ƽ���ϵ��
��������ˮ�����г�����ɱ��������HClO��ɱ��������ClO-ǿ��25��ʱ����-��ˮ��ϵ�д�������ƽ���ϵ��| A�� | Cl2��g��+H2O?2H++ClO-+Cl- K=10-10.9 | |
| B�� | pH=7.5ʱ�����ȴ�������ˮ��ϵ�У�c��Cl-��+c��HClO��=c��H+��-c��OH-�� | |
| C�� | ���ȴ�������ˮʱ��pH=6.5ʱɱ��Ч����pH=4.5ʱ�� | |
| D�� | �ȴ�������ˮʱ�����ļ���ɱ��Ч�����ڶ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڣ��٣��ۣ��� | B�� | �٣��ۣ��ܣ��� | C�� | �ڣ��ۣ��٣��� | D�� | �ڣ��ۣ��ܣ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com