

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪Mg(OH)2��Al(OH)3�ǹ�ҵ�ϳ��õ���ȼ�������ǵ��Ȼ�ѧ����ʽ�ֱ�Ϊ�� Mg(OH)2(s)==MgO(s)+H2O(g)�� ��H1=+81.5kJ��mol-1
Al(OH)3(s)=![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g)�� ��H2=+87.7kJ��mol-1
H2O(g)�� ��H2=+87.7kJ��mol-1
����˵����ȷ���� �� ��
A��Mg(OH)2��Al(OH)3���Dz�����ˮ�����ʣ����Կ�����ҵ��ȼ����
B��������Mg(OH)2��Al(OH)3��ȣ���ȼЧ���Ϻá�
C��Mg(OH)2�ļ��Ա�Al(OH)3ǿ�����ƶϽ�����Al��Mgǿ��
D��Mg(OH)2��Al(OH)3����ҵ��ȼ�������Ƿֽ���ﶼ�����²����ء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(12��) ��Ȼ��(��Ҫ�ɷּ���)��һ����ࡢ��Ч����Դ������������м�ͥ���ڳ���ʹ�õ�ȼ���Ѿ���ú��(��Ҫ�ɷ���H2��CO�������1�U1��ϵ���������)��������Ȼ����������Ȼ��Ҳ�Ǻܺõ�ȼ�ϵ�ص�ȼ�ϣ�������ȼ�ϵ���е�����ת���ʿɴﵽ85%��90%����ش��������⣺
����֪H2��CO��CH4��ȼ���ȷֱ���286kJ/mol��283 kJ/mol��890 kJ/mol����Ӧ2CH4(g)+3O2(g)=CO(g)+H2(g)+CO2(g)+3H2O(l)�ķ�Ӧ�� ��H= ��
���Լ��顢����Ϊ��Ӧ�KOH��Һ���������Һ����ȼ�ϵ�أ�����ӦʽΪ�� �����ŷ�Ӧ�IJ��Ͻ�����Һ��pH (�������С�����䡱)��
������Ը�ȼ�ϵ��Ϊ��Դ��ʯī��������ⱥ��ʳ��ˮ����õ�������������ӦʽΪ�� ��������һ��ʱ���NaCl��Һ�����Ϊ1L����Һ��pHΪ12�������������ļ����ڱ�״���µ����Ϊ�� mL��
�Ƚ����е����������Һȡ���������м��뺬��Mg2+��Fe2+����Һ�ף�Mg(OH)2��Fe(OH)2ͬʱ���ɣ���֪Mg(OH)2��Fe(OH)2�ڸ��¶��µ��ܶȻ������ֱ���2��10��11��8��10��16�������Һ��Mg2+��Fe2+��Ũ�ȱ�Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�������ʡ�����ص�һ��ѧ������ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
��12�֣���Ȼ��(��Ҫ�ɷּ���)��һ����ࡢ��Ч����Դ������������м�ͥ���ڳ���ʹ�õ�ȼ���Ѿ���ú��(��Ҫ�ɷ���H2��CO�������1�U1��ϵ���������)��������Ȼ����������Ȼ��Ҳ�Ǻܺõ�ȼ�ϵ�ص�ȼ�ϣ�������ȼ�ϵ���е�����ת���ʿɴﵽ85%��90%����ش��������⣺
����֪H2��CO��CH4��ȼ���ȷֱ���286kJ/mol��283 kJ/mol��890 kJ/mol����Ӧ2CH4(g)+3O2(g)=CO(g)+H2(g)+CO2(g)+3H2O(l)�ķ�Ӧ�ȡ�H= ��
���Լ��顢����Ϊ��Ӧ�KOH��Һ���������Һ����ȼ�ϵ�أ�����ӦʽΪ�� �����ŷ�Ӧ�IJ��Ͻ�����Һ��pH (�������С�����䡱)��
������Ը�ȼ�ϵ��Ϊ��Դ��ʯī��������ⱥ��ʳ��ˮ����õ�������������ӦʽΪ�� ��������һ��ʱ���NaCl��Һ�����Ϊ1L����Һ��pHΪ12�������������ļ����ڱ�״���µ����Ϊ�� mL��
�Ƚ����е����������Һȡ���������м��뺬��Mg2+��Fe2+����Һ�ף�Mg(OH)2��Fe(OH)2ͬʱ���ɣ���֪Mg(OH)2��Fe(OH)2�ڸ��¶��µ��ܶȻ������ֱ���2��10��11��8��10��16�������Һ��Mg2+��Fe2+��Ũ�ȱ�Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��Ȼ��(��Ҫ�ɷ��Ǽ���)��һ����ࡢ��Ч����Դ������������м�ͥ���ڳ���ʹ�õ�ȼ���Ѿ���ú��(��Ҫ�ɷ���H2��CO�������1�U1��ϵ���������)��������Ȼ����������Ȼ��Ҳ�Ǻܺõ�ȼ�ϵ�ص�ȼ�ϣ�������ȼ�ϵ���е�����ת���ʿɴﵽ85%��90%����ش��������⣺
��1���Լ��顢����Ϊ��Ӧ�KOH��Һ���������Һ����ȼ�ϵ�أ�����ӦʽΪ�� �����ŷ�Ӧ�IJ��Ͻ�����Һ��pH (�������С�����䡱)��
��2������Ը�ȼ�ϵ��Ϊ��Դ��ʯī��������ⱥ��ʳ��ˮ����õ�������������ӦʽΪ�� ��������һ��ʱ���NaCl��Һ�����Ϊ1L����Һ��pHΪ12�������������ļ����ڱ�״���µ����Ϊ�� mL��
��3������2���е����������Һȡ���������м��뺬��Mg2+��Fe2+����Һ�ף�Mg(OH)2��Fe(OH)2ͬʱ���ɣ���֪Mg(OH)2��Fe(OH)2�ڸ��¶��µ��ܶȻ������ֱ���2��10��11��8��10��16�������Һ��Mg2+��Fe2+��Ũ��֮��Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ��㶫ʡ÷���и�����ѧ����ĩ���ԣ����ۣ���ѧ���� ���ͣ�ѡ����
��֪Mg(OH)2 ��Al(OH)3���ǹ�ҵ�ϳ��õ���ȼ�������ǵ��Ȼ�ѧ����ʽ�ֱ�Ϊ
Mg(OH)2(s)===MgO(s)��H2O(g)�� ��H1=��81.5kJ��mol��1
Al(OH)3(s)===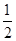 Al2O3(s)��
Al2O3(s)��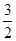 H2O(g)�� ��H2=��87.7kJ��mol��1
H2O(g)�� ��H2=��87.7kJ��mol��1
������˵������ȷ����
A��Mg(OH)2 ��Al(OH)3���Dz�����ˮ�����ʣ����Կ�����ҵ��ȼ��
B��������Mg(OH)2 ��Al(OH)3��ȣ�Al(OH)3����ȼЧ���Ϻ�
C����Mg(OH)2 �ļ��Ա�Al(OH)3ǿ�����ƶϽ�����Mg��Alǿ
D��Mg(OH)2 �� Al(OH)3����ҵ��ȼ�������ǵķֽ���ﶼ�����²�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com