
下列有机物的命名正确的是( )
A.二溴乙烷:
B.3乙基1丁烯: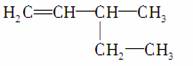
C.2甲基2,4己二烯: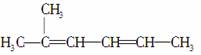
D.2,2,3三甲基戊烷: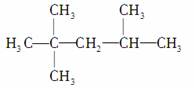
科目:高中化学 来源: 题型:
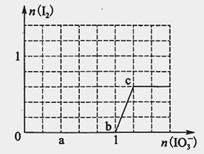
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;反应中还原剂是______________;被还原的元素是__。
(2)写出b点到c点反应的离子方程式_____________________________。
(3)若往100 mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是 ( ) 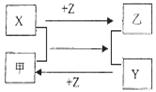
A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.如果X、Y都为非金属单质,则Z必为金属单质
D.如果X、Y都为金属单质,则Z必为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C10H20O2的有机物在酸性条件下可水解为醇A和酸B,A经过连续氧化可转化为B,若不考虑立体异构,符合上述要求的醇和酸若重新组合,可形成的酯共有:( )
A.32 B.16 C.8 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO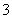 并没有产生CO2则反应的离子反应方程式为 。
并没有产生CO2则反应的离子反应方程式为 。
(3)海水提镁的一段工艺流程如下图:
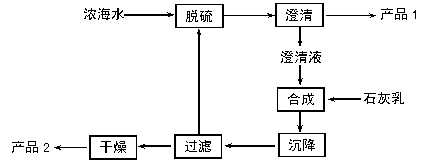 |
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_________,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C2H4O2的结构可能有 和
和 两种,为对其结构进行物理方法鉴定,可用______________或________________。
两种,为对其结构进行物理方法鉴定,可用______________或________________。
(1)若为 ,则红外光谱中应该有____个振动吸收;核磁共振氢谱中应该有__________个峰。
,则红外光谱中应该有____个振动吸收;核磁共振氢谱中应该有__________个峰。
(2)若为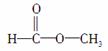 ,则红外光谱中有______个振动吸收;核磁共振氢谱中应有______个峰。
,则红外光谱中有______个振动吸收;核磁共振氢谱中应有______个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实所列出的相应结论正确的是
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃,而氮气须在放电时才与氧 气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
、下列说法中正确的是( )
A、煤燃烧是化学能转化为光能的过程
B、1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C、HCl 和 NaOH 反应的中和热 ΔH=-57.3 kJ·mol-1,则 H2SO4 和 Ca(OH)2 反应中和热
ΔH=2×(-57.3)kJ·mol-1
D、反应 H2(g)+F2(g)===2HF(g);ΔH=-270 kJ·mol-1说明在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com