
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g/L |
| 排放标准 | pH 6~9 | 0.5mg/L |
| ||
| 1L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、SO42-的空间构型是正四面体形 |
| B、CS2分子中各原子均达8电子稳定结构 |
| C、CH3COOH分子中碳原子的杂化类型有sp2和sp3两种 |
| D、H2O2分子是既含极性键又含非极性键的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
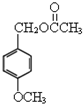 乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图:
乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图: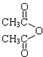 )反应制得.写出反应的化学方程式:
)反应制得.写出反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
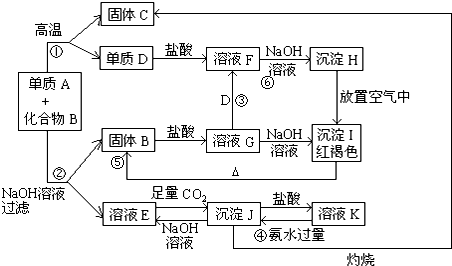
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
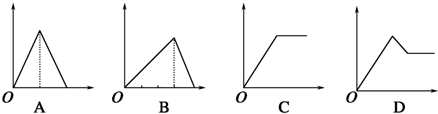
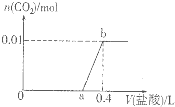 向NaOH和Na2CO3混合溶液中滴加0.1molgL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )
向NaOH和Na2CO3混合溶液中滴加0.1molgL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )| A、在0-a范围内,只发生中和反应 |
| B、ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O |
| C、a=0.2 |
| D、原混合溶液中NaOH与Na2CO3的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是离子化合物在离子方程式中都要以离子来表示 |
| B、离子互换反应总是向着溶液中离子浓度减小的方向进行 |
| C、酸碱中和反应的实质是H+和OH-结合生成水,故酸碱中和反应的离子方程式都是H++OH-=H2O |
| D、复分解反应必须具备离子反应生成的三个条件才能进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com