
| t/min | 0 | 10 | 20 | 30 | 40 |
| c(H2O2) mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |

分析 (1)有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降;双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)v(H2O2)=$\frac{△c}{△t}$;
(3)0─40min内消耗n(H2O2)=(0.80-0.08)mol/L×0.1L=0.075mol,根据双氧水和氧气的关系式计算氧气物质的量,再根据m=nM计算氧气质量.
解答 解:(1)有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降,该反应中O元素化合价由-1价变为0价、-2价,所以有电子转移,为氧化还原反应;双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ;
;
故答案为:是; ;
;
(2)v(H2O2)=$\frac{△c}{△t}$=$\frac{(0.80-0.20)mol/L}{20min}$=0.03mol/(L.min),
故答案为:0.03;
(3)0─40min内消耗n(H2O2)=(0.80-0.05)mol/L×0.1L=0.075mol,根据双氧水和氧气的关系式得n(O2)=$\frac{1}{2}$n(H2O2)=0.0375mol,氧气质量m=nM=0.0375mol×32g/mol=1.2g;
故答案为:D.
点评 本题考查氧化还原反应判断、电子式、根据方程式的计算、化学反应速率计算等基本计算、概念,侧重考查学生分析计算能力,注意氧化还原反应本质和特征区别,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HO3(浓)=3Cu(NO3)2+2NO↑+4H2O | ||
| C. |  | D. | 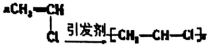 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含等物质的量的HNO3、Na2CO3、CH3COOH的溶液 | |
| B. | pH=1的盐酸与pH=13的氨水等体积混合 | |
| C. | 0.05mol/L的H2SO4和0.1mol/L的KOH等体积混合 | |
| D. | pH=2的CH3COOH和pH=12的NaOH等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ⑨淀粉和纤维素
⑨淀粉和纤维素查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我们使用合金是因为它比纯金属具有更优良的机械性能 | |
| B. | 钢化玻璃、有机玻璃、石英玻璃均属于硅酸盐材料 | |
| C. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| D. | 高纯度的二氧化硅广泛应用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com