
【题目】(1)写出正丁烷的结构简式:___________;写出漂白粉有效成分的化学式:__________。
(2)写出镁条和氮气反应的化学方程式_____________________________________。写出铁和氯化铁溶液反应的离子方程式___________________________________。写出乙烯和水反应的化学方程式___________________________________。
【答案】CH3CH2CH2CH3 Ca(ClO)2 3Mg+N2![]() Mg3N2 Fe+2Fe3+=3Fe2+ H2C=CH2+H2O
Mg3N2 Fe+2Fe3+=3Fe2+ H2C=CH2+H2O![]() CH3CH2OH
CH3CH2OH
【解析】
(1)根据漂白粉的制取原理判断其有效成分;
(2)镁条在氮气中燃烧生成氮化镁;铁与铁离子发生归中反应生成亚铁离子;乙烯和水在催化剂的作用下发生加成反应生成乙醇。
(1)正丁烷的结构简式为CH3CH2CH2CH3;
用氯气与石灰乳反应制取漂白粉,反应原理为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,其中漂白粉的有效成分为Ca(ClO)2;
(2)镁条在氮气中燃烧生成氮化镁,反应的化学方程式为3Mg+N2![]() Mg3N2;
Mg3N2;
铁与铁离子发生反应生成亚铁离子,反应的离子方程式为Fe+2Fe3+=3Fe2+;
乙烯和水在催化剂的作用下发生加成反应生成乙醇,反应的化学方程式为H2C=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。


科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是
A. 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B. 12g石墨中含有σ键的个数为2NA (NA表示阿伏伽德罗常数)
C. 氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D. 干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A.锂电极发生还原反应
B.多孔碳材料电极为正极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:O2+4e-+2H2O====4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在最新的家用汽车的调查中发现,新车中气体的质量不符合标准。汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物。其中一种有毒物质为A,为了测定有机物A的结构,做如下实验:
①将9.2g该有机物完全燃烧,生成标况下15.68L的CO2和7.2g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;

(1)则由图可知该分子的相对分子质量是___,有机物A的分子式为____。
(2)用核磁共振仪处理该化合物得到四个峰,且面积之比是1∶2∶2:3,则有机物的名称为___,其苯环上的一氯代物有___种。若将有机物A与氢气完全加成,则加成后的有机物的一氯代物共有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图①一④的相关信息,下列相应叙述正确的是
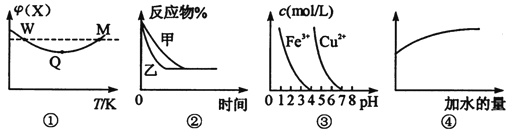
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)![]() 3Z(g) △H<0,W点X的正反应速率等于M点X的正反应速率
3Z(g) △H<0,W点X的正反应速率等于M点X的正反应速率
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3 C(g)+D(s)的影响,乙的压强比甲压强小
3 C(g)+D(s)的影响,乙的压强比甲压强小
C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
D.常温下,稀释0.1 mol·L-1Na2CO3溶液,图④中的纵坐标可以表示溶液中HCO3-的数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Na2S的水解:S2-+ 2H2O![]() H2S + 2OH
H2S + 2OH
B.NaHCO3在水溶液中的电离:HCO3+ H2O![]() H2 CO3+ OH
H2 CO3+ OH
C.NH4Cl的水解:NH4+ + H2O![]() NH3·H2O + OH
NH3·H2O + OH
D.硫酸铝溶液和碳酸氢钠溶液混合: Al3+ + 3HCO3 = Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)=Y(s)+2Z(g) ΔH>0,反应达到最大限度前,测得X的浓度与反应时间的数据如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/mol·L-1 | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
试回答下列问题:
(1)0~3min内,用Z表示的平均反应速率v(Z)=___。
(2)分析该反应中反应物的浓度随时间的变化规律,得出的结论是___。由此结论推出a为___。
(3)该反应的逆反应速率随时间变化的关系如图所示,t2时改变了某一反应条件,则改变的条件为___。
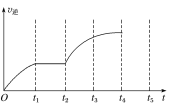
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:图甲是由某温度下![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是
图甲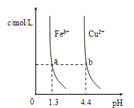 图乙
图乙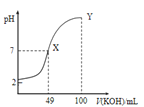
A.由图甲知:![]()
B.由图甲知:a、b点溶液中![]() ,b点的大
,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com