
【题目】短周期元素X、Y、Z、W、Q原子序数依次增大。已知:X的最外层电子数是次外层的2倍,在地壳中Z的含量最大,W是短周期元素中原子半径最大的主族元素,Q的最外层比次外层少2个电子。请回答下列问题:
(1)X的价层电子排布式是___,Q的原子结构示意图是____。
(2)Y、Z两种元素中,第一电离能较大的是(填元素符号)_____,原因是______。
(3)Z、W、Q三种元素的简单离子的半径从小到大排列的是________。
(4)关于Y、Z、Q三种元素的下列有关说法,正确有是_______;
A.Y的轨道表示式是:
B.Z、Q两种元素的简单氢化物的稳定性较强的是Z
C. Z、Q两种元素简单氢化物的沸点较高的是Q
D.Y常见单质中σ键与π键的数目之比是1:2
(5)Q与Z形成的化合物QZ2,中心原子Q的杂化类型是_____,QZ2易溶于水的原因是________。
【答案】2s22p2 ![]() N N原子的2p轨道为半充满结构,能量低稳定 r(Na+)<r(O2-) <r(S2-) BD sp2杂化 SO2是极性分子,H2O是极性溶剂,相似相溶;SO2与H2O反应生成易溶于水的H2SO3
N N原子的2p轨道为半充满结构,能量低稳定 r(Na+)<r(O2-) <r(S2-) BD sp2杂化 SO2是极性分子,H2O是极性溶剂,相似相溶;SO2与H2O反应生成易溶于水的H2SO3
【解析】
X的最外层电子数是次外层的2倍,则次外层只能是K层,容纳2个电子,最外层是L层,有4个电子,X为C元素。地壳中Z的含量最大,则Z为O元素,X、Y、Z原子序数依次增大,则Y为N元素。W是短周期元素中原子半径最大的主族元素,W为Na。Q的最外层比次外层少2个电子,Q的次外层为L层,有8个电子,Q的最外层为M层,有6个电子,Q为S元素。
(1)X为C元素,核外电子排布为1s22s22p2,价层电子排布式为2s22p2;Q为S元素,16号元素,原子结构示意图为![]() ;
;
(2)Y为N元素,Z为O元素,第一电离能大的是N元素,原因是N原子的2p轨道为半充满结构,能量低稳定;
(3)Z、W、Q形成的离子分别为O2-、Na+、S2-。O2-和Na+具有相同的核外电子排布,核电荷数越大,半径越小,则有r(Na+ )<r(O2-)。O和S同主族,同主族元素形成的简单离子半径从上到小依次增大,有r(O2-) <r(S2-),则排序为r(Na+ )<r(O2-) <r(S2-);
(4)Y为N,Z为O,Q为S ;
A.Y的2p轨道上有3个电子,根据洪特原则,电子排布在能量相同的各个轨道时,电子总是尽可能分占不同的原子轨道,且自旋状态相同,2p轨道上的3个电子,应该分别在3个不同的轨道;A项错误;
B.O的氢化物H2O的稳定性比S的氢化物H2S的稳定性强,因为O非金属性比S的强;B项正确;
C.O的氢化物H2O的沸点比S的氢化物H2S的沸点高,原因是水分子间存在氢键;C项错误;
D.Y的单质为N2,N和N原子之间有3对共用电子对,其中σ键有1个,π键有2个,比例为1:2,D项正确;
本题答案选BD;
(5)QZ2为SO2,中心原子S的价电子有6个,配位原子O不提供电子,对于SO2,VP=BP+LP=2+![]() =3,中心S原子为sp2杂化;根据相似相溶的原理,SO2易溶于水是由于SO2是极性分子,H2O是极性溶剂,相似相溶;另外SO2与H2O反应生成易溶于水的H2SO3。
=3,中心S原子为sp2杂化;根据相似相溶的原理,SO2易溶于水是由于SO2是极性分子,H2O是极性溶剂,相似相溶;另外SO2与H2O反应生成易溶于水的H2SO3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是( )
A.水玻璃中滴入酚酞呈红色:SiO32-+2H2O ![]() H2SiO3+2OH-
H2SiO3+2OH-
B.Ba(NO3)2溶液中通入过量SO2:3SO2+ 3Ba2++ 2NO3- + 2H2O= 3BaSO4↓ + 2NO↑ + 4H+
C.NH4Al(SO4)2溶液中滴入过量NaOH溶液:NH4++Al3++5OH-=Al(OH)4- +NH3·H2O
D.AgNO3溶液中滴入足量氨水中:Ag++2NH3·H2O=Ag(NH3)2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硫酸反应的装置如图所示。下列描述合理的是( )
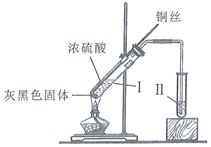
A.反应过程中,试管Ⅰ中出现灰黑色固体是![]()
B.反应结束后,为观察溶液颜色需向试管Ⅰ中加入水
C.若试管Ⅱ盛放紫色石蕊溶液,可观察到紫色褪至无色
D.为验证气体产物具有还原性,试管Ⅱ可盛放溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验主要仪器和试剂的选择不能达到实验目的的是
选项 | 主要仪器 | 试剂 | 实验目的 |
A | 烧瓶、长颈漏斗、酒精灯、导管 | 软锰矿与浓盐酸 | 制取并收集干燥的氯气 |
B | 酒精灯、玻璃棒、蒸发皿、三脚架 |
| 蒸发溶液得到晶体 |
C | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的氨气、水 | 模拟喷泉实验 |
D | 铁丝、蓝色钴玻璃、酒精灯 | 盐酸、待测液 | 焰色反应实验 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
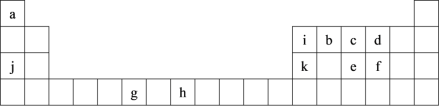
用化学用语回答下列问题:
(1)写出元素g的基态原子核外电子排布式______,h2+中未成对电子数为____。
(2)在b2a2分子中,元素b为__杂化,该分子是___分子(填“极性”或“非极性”),该分子中σ键和π键的数目比为____。
(3)bd2与bf2比较,沸点较高的是___(填分子式),原因是_______。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是___。
A h位于元素周期表中第四周期第VIII族,属于d区元素
B e的基态原子中,3p能级为半充满,属于p区元素
C 最外层电子排布式为4s2,一定属于IIA族
D 最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族
(5)i元素最高价含氧酸是一元弱酸,它的水溶液之所以呈弱酸性并非本身能电离出H+,而是它加合了一个OH-,形成配位键,请用“→”表示);请用离子方程式表示____与ia4-互为等电子体的一种阳离是____,ia4-的空间构型为___。
(6)下表是一些气态原子逐级电离能(kJ·mol-1):

①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量___________
②表中X可能为以上元素中的____元素(填写元素符号)。Y与X的最高价氧化物的水化物溶液反应的离子方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家F.Haber利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
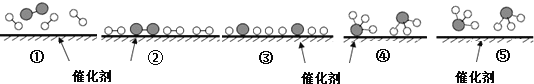
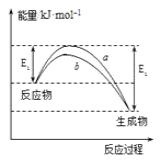
A. 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
B. 催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C. 在该过程中,N2、H2断键形成N原子和H原子
D. 使用催化剂,合成氨反应放出的热量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH≡CH和CH2=CHCH=CH2互为同系物
B.![]() 互为同分异构体
互为同分异构体
C.有机物![]() 的二氯代物有5种
的二氯代物有5种
D.(CH3)3C-CH=CH2与氢气加成后,生成2,2,3—三甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向VmL0.1mol·L-1HA溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( )
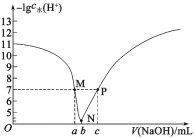
A.常温下,Ka(HA)约为10-5
B.P点溶液对应的pH=7
C.M点溶液中存在:c(Na+)=c(A-)+c(HA)
D.N点溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据题意选择下列物质,并用其字母代号填空:
A.CH3COOC2H5 B.CH2=CH2 C.![]() D.CH3COOH E.C6H12O6 F.(C6H10O5)n
D.CH3COOH E.C6H12O6 F.(C6H10O5)n
(1)属于食醋的主要成分的是___,
(2)具有芳香气味的是___,
(3)可以作为植物生长调节剂的是___,
(4)属于芳香烃的是___,
(5)血糖较低时,可及时补充的是___,
(6)植物的根、茎、叶、果皮主要含有的有机成分是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com