
| A、氯气用于制备漂白粉 |
| B、单质硅用于制造光导纤维 |
| C、氧化铝的熔点很高,可用于制作耐高温材料 |
| D、三氧化二铁用于生产红色颜料 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、电解过程中,溶液的pH不断增大 |
| B、当转移0.4mol 电子时,电解生成的铜为12.8g |
| C、阴极反应式为2H2O+4e-=4H++O2↑ |
| D、整个过程中产生的H2与O2的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
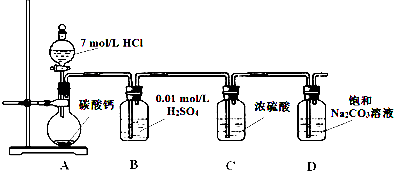
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冶炼金属铝通常用电解氯化铝的方法 |
| B、要使海水淡化通常有蒸馏法和离子交换法 |
| C、用H2作为燃料的优点之一是燃烧后的产物不污染环境 |
| D、煤的干馏属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通常状况下将0.5mol HI气体和0.5 mol Cl2混合后,气体的分子数小于NA |
| B、同温同压下,相同体积的物质,其物质的量必相等 |
| C、5.3g Na2CO3固体含有的离子数为1.5NA |
| D、标准状况下,0.5 NA个Br2所占的体积约为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、试液
| ||||
B、试液
| ||||
C、试液
| ||||
D、试液
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (g)
(g)| FeSO4/Al2O3 |
| 高温 |
 (g)+3H2(g)
(g)+3H2(g)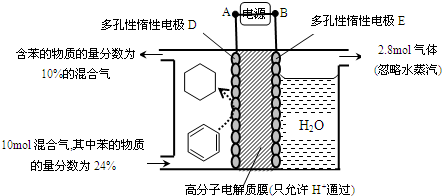
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com