
| C(H+) | C(SO42—) | C(Fe2+、Fe3+) |
| | | |
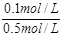 ×100%=20%
×100%=20%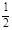 c(H+)
c(H+) c(SO42—)-
c(SO42—)-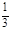 c(H+)
c(H+)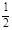 c(H+)> c(Fe2+、Fe3+)>
c(H+)> c(Fe2+、Fe3+)> c(SO42—)-
c(SO42—)-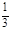 c(H+)
c(H+) 

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-2 | B.0 | C.+4 | D.+2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 混合,恰好能被水完全吸收,则a和b的关系可能是
混合,恰好能被水完全吸收,则a和b的关系可能是| A.b>0.3a | B.b<0.2a | C.0.2 .3a .3a | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+2 | B.+3 | C.+4 | D.+6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com