
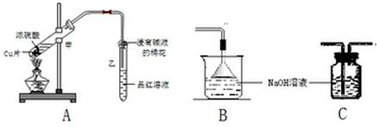
·ÖĪö £Øl£©ŹŌ¹Ü¼×ÖŠCuŗĶÅØĮņĖįŌŚ¼ÓČČĢõ¼žĻĀ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĮņĖįĶ”¢¶žŃõ»ÆĮņŗĶĖ®£»
¶žŃõ»ÆĮņŹōÓŚĖįŠŌŃõ»ÆĪļĒŅÓŠ¶¾£¬½ųČėæÕĘų»įĪŪČ¾“óĘų£»
£Ø2£©ĮņĖįĶČÜŅŗ³ŹĄ¶É«£¬¶žŃõ»ÆĮņÄÜŹ¹Ę·ŗģČÜŅŗĶŹÉ«¶ųĢåĻÖĘư׊Ō£»
£Ø3£©¶žŃõ»ÆĮņŹōÓŚĖįŠŌŃõ»ÆĪļ£¬ÄÜŗĶ¼īŠŌŃõ»ÆĪļ·“Ӧɜ³ÉŃĪ£»
£Ø4£©ŌŚŹŹµ±µÄĪĀ¶Č²¢ÓŠŅ»¶Ø“߻ƼĮ“ęŌŚµÄĢõ¼žĻĀ¶žŃõ»ÆĮņŗĶŃõĘų·“Ӧɜ³ÉSO3£»
£Ø5£©¶žŃõ»ÆĮņÓŠ¶¾£¬²»ÄÜÖ±½ÓÅÅæÕ£¬Ó¦øĆÓĆ¼īŠŌČÜŅŗĪüŹÕĪ²Ęų£¬ĒŅĪüŹÕĪ²ĘųŹ±ŅŖ·ĄÖ¹µ¹Īü£®
½ā“š ½ā£ŗ£Øl£©ŹŌ¹Ü¼×ÖŠCuŗĶÅØĮņĖįŌŚ¼ÓČČĢõ¼žĻĀ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĮņĖįĶ”¢¶žŃõ»ÆĮņŗĶĖ®£¬·“Ó¦·½³ĢŹ½ĪŖCu+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CuSO4+SO2”ü+2H2O£»
¶žŃõ»ÆĮņŹōÓŚĖįŠŌŃõ»ÆĪļĒŅÓŠ¶¾£¬½ųČėæÕĘų»įĪŪČ¾“óĘų£¬ĪŖ·ĄÖ¹Éś³ÉµÄ¶žŃõ»ÆĮņ½ųČėæÕĘų£¬Ó¦øĆÓĆ¼īŅŗNaOHĪüŹÕ£¬ŌņĆŽ»ØµÄ×÷ÓĆŹĒĪüŹÕÓŠ¶¾µÄĪ²Ęų£¬·ĄÖ¹ĪŪČ¾“óĘų£¬
¹Ź“š°øĪŖ£ŗCu+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CuSO4+SO2”ü+2H2O£»ĪüŹÕÓŠ¶¾µÄĪ²Ęų£¬·ĄÖ¹ĪŪČ¾“óĘų£»
£Ø2£©ĮņĖįĶČÜŅŗ³ŹĄ¶É«£¬¼×ÖŠÉś³ÉĮņĖįĶ£¬ĖłŅŌČÜŅŗ±äĪŖĄ¶É«£¬¶žŃõ»ÆĮņÄÜŹ¹Ę·ŗģČÜŅŗĶŹÉ«¶ųĢåĻÖĘư׊Ō£¬ŌņĘ·ŗģČÜŅŗĶŹÉ«£¬¹Ź“š°øĪŖ£ŗĄ¶£»ĶŹÉ«£»ĘÆ°×£»
£Ø3£©¶žŃõ»ÆĮņŹōÓŚĖįŠŌŃõ»ÆĪļ£¬ÄÜŗĶ¼īŠŌŃõ»ÆĪļ·“Ӧɜ³ÉŃĒĮņĖįŃĪ£¬ĖłŅŌ¶žŃõ»ÆĮņŗĶCaO·“Ӧɜ³ÉŃĒĮņĖįøĘ£¬
·“Ó¦·½³ĢŹ½ĪŖSO2+CaO=CaSO3£¬¹Ź“š°øĪŖ£ŗSO2+CaO=CaSO3£»
£Ø4£©ŌŚŹŹµ±µÄĪĀ¶Č²¢ÓŠŅ»¶Ø“߻ƼĮ“ęŌŚµÄĢõ¼žĻĀ¶žŃõ»ÆĮņŗĶŃõĘų·“Ӧɜ³ÉSO3£¬·“Ó¦·½³ĢŹ½ĪŖ2SO2+O2$\frac{\underline{“߻ƼĮ}}{”÷}$2SO3£¬
¹Ź“š°øĪŖ£ŗ2SO2+O2$\frac{\underline{“߻ƼĮ}}{”÷}$2SO3£»
£Ø5£©¶žŃõ»ÆĮņÓŠ¶¾£¬²»ÄÜÖ±½ÓÅÅæÕ£¬Ó¦øĆÓĆ¼īŠŌČÜŅŗĪüŹÕĪ²Ęų£¬ĒŅĪüŹÕĪ²ĘųŹ±ŅŖ·ĄÖ¹µ¹Īü£¬µ¹ÖƵÄĀ©¶·ÓŠ·Ąµ¹Īü×÷ÓĆ£¬¹ŹŃ”B£®
µćĘĄ ±¾ĢāŅŌÅØĮņĖįŗĶCu·“Ó¦ĪŖŌŲĢåæ¼²éŠŌÖŹŹµŃé·½°øĘĄ¼Ū£¬ĪŖøßĘµæ¼µć£¬Ć÷Č·ŹµŃéŌĄķ¼°ĪļÖŹŠŌÖŹŹĒ½ā±¾Ģā¹Ų¼ü£¬“ÓĪļÖŹÖʱø”¢ĪļÖŹŠŌÖŹ”¢Ī²Ęų“¦ĄķµČ·½Ćę·ÖĪöĘĄ¼Ū£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
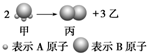 ČēĶ¼ĖłŹ¾£ŗŅŃÖŖ¼×”¢ŅŅ”¢±ū³£ĪĀĻĀ¶¼ĪŖĘųĢ壮
ČēĶ¼ĖłŹ¾£ŗŅŃÖŖ¼×”¢ŅŅ”¢±ū³£ĪĀĻĀ¶¼ĪŖĘųĢ壮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 øßĢśĖįŃĪŌŚÄÜŌ“»·±£ĮģÓņÓŠ¹ć·ŗÓĆĶ¾£®ÓĆÄų£ØNi£©”¢Ģś×÷µē¼«µē½āÅØNaOHČÜŅŗÖʱøøßĢśĖįŃĪNa2FeO4µÄ×°ÖĆČēĶ¼ĖłŹ¾£®ĻĀĮŠĶʶĻŗĻĄķµÄŹĒ£Ø””””£©
øßĢśĖįŃĪŌŚÄÜŌ“»·±£ĮģÓņÓŠ¹ć·ŗÓĆĶ¾£®ÓĆÄų£ØNi£©”¢Ģś×÷µē¼«µē½āÅØNaOHČÜŅŗÖʱøøßĢśĖįŃĪNa2FeO4µÄ×°ÖĆČēĶ¼ĖłŹ¾£®ĻĀĮŠĶʶĻŗĻĄķµÄŹĒ£Ø””””£©| A£® | ĢśŹĒŃō¼«£¬µē¼«·“Ó¦ĪŖ Fe-6e-+4H2O=FeO42-+8H+ | |
| B£® | µē½āŹ±µē×ÓµÄĮ÷¶Æ·½ĻņĪŖ£ŗøŗ¼«”śNiµē¼«”śČÜŅŗ”śFeµē¼«”śÕż¼« | |
| C£® | ČōøōĤĪŖŅõĄė×Ó½»»»Ä¤£¬Ōņµē½ā½įŹųŗó×ó²ąČÜŅŗÖŠŗ¬ÓŠFeO42- | |
| D£® | µē½āŹ±Ńō¼«ĒųpH ½µµĶ”¢Ņõ¼«Ēų pHÉżøߣ¬³·Č„øōĤ»ģŗĻŗó£¬ÓėŌČÜŅŗ±Č½Ļ pHÉżøߣؼŁÉčµē½āĒ°ŗóĢå»ż±ä»ÆŗöĀŌ²»¼Ę£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ”°æÉČ¼±ł”±ÓŠæÉÄܳÉĪŖČĖĄąĪ“Ą“µÄÖŲŅŖÄÜŌ“ | |
| B£® | ”°æÉČ¼±ł”±ŹĒŅ»ÖÖ±Č½Ļ½ą¾»µÄÄÜŌ“ | |
| C£® | ”°æÉČ¼±ł”±Ģį¹©ĮĖĖ®æÉÄܱä³ÉÓĶµÄĄżÖ¤ | |
| D£® | ”°æÉČ¼±ł”±µÄÖ÷ŅŖæÉČ¼³É·ÖŹĒ¼×Ķé |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·“Ó¦²»ŌŁ½ųŠŠ | B£® | ·“Ó¦ĪļÅØ¶ČµČÓŚÉś³ÉĪļÅØ¶Č | ||
| C£® | ø÷×é·ÖÅØ¶Č²»ŌŁĖꏱ¼ä¶ų±ä»Æ | D£® | ·“Ó¦ĪļµÄÖŹĮæµČÓŚÉś³ÉĪļµÄÖŹĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČĪļÖŹµÄĮæµÄ¹ĢĢåÓė×ćĮæµÄŃĪĖį·“Ó¦·Å³öCO2µÄÖŹĮæ£ŗNa2CO3£¾NaHCO3 | |
| B£® | ĻąĶ¬Ģõ¼žĻĀ£¬ČÜÓŚĖ®ČÜŅŗµÄ¼īŠŌ£ŗNa2CO3£¼NaHCO3 | |
| C£® | ³£ĪĀĻĀ£¬ŌŚĖ®ÖŠµÄČܽā¶Č£ŗNa2CO3£¾NaHCO3 | |
| D£® | ĻąĶ¬Ģõ¼žĻĀ£¬ÓėĻ”ŃĪĖį·“Ó¦µÄæģĀż£ŗNa2CO3£¾NaHCO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »Æѧ·“Ó¦ĖŁĀŹŹĒÖøŅ»¶ØŹ±¼äÄŚČĪŗĪŅ»ÖÖ·“Ó¦ĪļÅØ¶ČµÄ¼õÉŁ»ņÕßČĪŗĪŅ»ÖÖÉś³ÉĪļÅØ¶ČµÄŌö¼Ó | |
| B£® | »Æѧ·“Ó¦ĖŁĀŹĪŖ”°0.8 mol/£ØL•s£©”±±ķŹ¾µÄŅāĖ¼ŹĒ£ŗŹ±¼äĪŖ1 sŹ±£¬Ä³ĪļÖŹµÄÅضČĪŖ0.8 mol/L | |
| C£® | ¶ŌÓŚČĪŗĪ»Æѧ·“Ó¦Ą“Ėµ£¬·“Ó¦ĖŁĀŹŌ½“󣬷“Ó¦ĻÖĻóŌ½Ć÷ĻŌ | |
| D£® | øł¾Ż»Æѧ·“Ó¦ĖŁĀŹµÄ“óŠ”æÉŅŌÖŖµĄ»Æѧ·“Ó¦½ųŠŠµÄæģĀż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘšŃĪĪö×÷ÓĆ | B£® | Ęš±äŠŌ×÷ÓĆ | C£® | Éś³ÉÄņĖŲ | D£® | Ė®½ā |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com