
【题目】已知E1=134kJ/mol、E2=368kJ/mol,请参考题中图表,按要求填空: 
(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,NO2和CO反应的热化学方程式为: .
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应. 反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)△H3
则△H3与△H1、△H2之间的关系是:△H3= .
(3)下表所示是部分化学键的键能参数:
化学键 | P﹣P | P﹣O | O═O | P═O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热为d kJ/mol,白磷及其完全燃烧生成的产物的结构如图Ⅱ所示,表中x= kJ/mol(用含a、b、c、d的代数式表示).
【答案】
(1)NO2(g)+CO(g)═NO(g)+CO2(g)△H=﹣234kJ?mol﹣1
(2)2△H2﹣△H1
(3)![]() (6a+5c+d﹣12b)
(6a+5c+d﹣12b)
【解析】解:(1)该反应的焓变△H=E1﹣E2=134KJ/mol﹣368KJ/mol=﹣234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=﹣234kJmol﹣1,
所以答案是:NO2(g)+CO(g)═NO(g)+CO2(g)△H=﹣234kJmol﹣1;(2)①2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)△H1
②NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)△H2,2×②﹣①得,(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)△H3=2△H2﹣△H1,
所以答案是:2△H2﹣△H1;(3)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P﹣P、5mol O=O,形成12molP﹣O、4mol P=O,
所以12mol×bkJ/mol+4mol×xkJ/mol﹣(6mol×a kJ/mol+5 mol×c kJ/mol)=dkJ/mol,x= ![]() (6a+5c+d﹣12b),
(6a+5c+d﹣12b),
所以答案是: ![]() (6a+5c+d﹣12b).
(6a+5c+d﹣12b).
【考点精析】关于本题考查的反应热和焓变,需要了解在化学反应中放出或吸收的热量,通常叫反应热才能得出正确答案.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH﹣ ![]() 2CO32﹣+6H2O,则下列说法错误的是( )
2CO32﹣+6H2O,则下列说法错误的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
D.充电时每生成1molCH3OH转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。

(1)若氨气的发生装置选择a,则其化学反应方程式为_________。
(2)若氨气的发生装置选择b,则所用的试剂为_____和_______。
(3)B装置中的干燥剂可选用___________。
(4)实验中观察到C装置中的现象是___________。
(5)当实验进行一段时间后,挤压D装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是________________。
(6)E中倒扣漏斗的作用是_________________。
(7)写出证明b装置的气密性良好的操作与现象_________________。
(8)用c装置做氨气喷泉实验时,如果没有胶头滴管,请写出引发喷泉的简单操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2NaBr + Cl2 == 2NaCl + Br2,下列说法正确的是
A. Cl2是氧化剂,反应中Cl原子得到电子
B. 当1molCl2完全反应时,有2mol电子发生转移
C. NaBr是还原剂,反应中溴离子得到电子
D. 当1molNaBr完全反应时,有1mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0~a范围内,只发生中和反应
B. a=0.3
C. ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
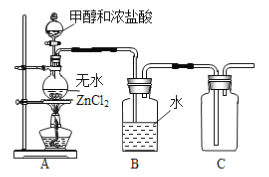
(1)某小组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
①无水ZnCl2为催化剂,圆底烧瓶中发生反应的化学方程式为___________,如果实验时圆底烧瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____________。
②装置B的主要作用是____________。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1 mL c1 mol·L-1 NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol·L-1盐酸标准液对吸收液进行返滴定,最终消耗V2 mL盐酸。则所收集CH3Cl的物质的量为________mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:
化学键 | C—Cl | C—Br |
键能(kJ·mol-1) | 330 | 276 |
化合物 | AgCl | AgBr |
Ksp | 1.8×10-10 | 5×10-13 |
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式______________。
②CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
③设计实验证明Ksp(AgCl)>Ksp(AgBr):___________(简要说明实验操作、现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al2O3两种工艺的流程如下:
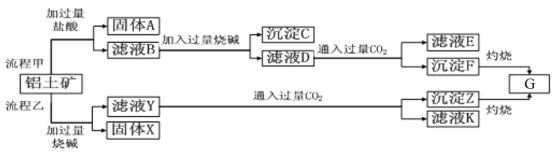
请回答下列问题:
(1)流程乙加入烧碱后和SiO2反应的离子方程式为________________________________。
(2)流程甲滤液D中通入过量CO2的化学方程式为_______________________________。
(3)验证滤液B中是否含有Fe3+的方法:_____________________________。
(4)写出滤液E中溶质的一种用途_________________________________。
(5)由物质G制取铝的化学方程式为__________________________。
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X。已知每转移3mole-,有1.5mol化合物X生成,此反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Y原子的最外层电子数是内层电子数的2倍,Z、W在元素周期表中处于同周期相邻的位置,它们的单质在常温下均为无色气体。试回答:
(1)写出下列元素的元素符号: X ________ ,Y ________ ,Z _________,W__________
(2)X的单质和Z的单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件)________________________ 。
(3)这四种元素可组成原子个数比为5:1:1:3(按X、Y、Z、W的顺序)的化合物化学式为_____________ ,含有化学键有 _________、_____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com