
| △c |
| △t |
| 消耗量 |
| 起始量 |
| ||
| 5min |
| 1 |
| 2 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
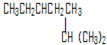 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、要配制100mL 1mol/L NaOH溶液,需在白纸上称4g NaOH固体,并且称量速度较慢 |
| B、称量时托盘天平的砝码已被锈蚀 |
| C、溶解或稀释溶质时烧杯尚未干燥 |
| D、定容时盖上瓶盖,摇匀后发现液面低于刻度线,再继续滴加蒸馏水使液面重新达到刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com