
分析 (1)①MnOOH中O元素化合价为-2价、H元素化合价为+1价,该化学式中各元素化合价的代数和为1确定Mn的化合价;主族元素原子核外电子层数与其周期数相同,最外层电子数与其族序数相等,据此判断O在元素周期表的位置;
②根据减少的质量与生成的二氧化锰之间的关系式计算;
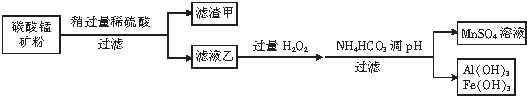
(2)碳酸锰矿主要成分为MnCO3、MnO2、FeCO3、SiO2、Al2O3,将碳酸锰矿中加入稍过量的稀硫酸,MnCO3、FeCO3、Al2O3和稀硫酸反应分别生成MnSO4、FeSO4、Al2(SO4)3,MnO2氧化性大于Fe3+,则MnO2和Fe2+在酸性条件下发生反应MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,SiO2不反应,过滤后,滤渣成分为SiO2,滤液乙中含有MnSO4、Al2(SO4)3、Fe2(SO4)3,向滤液乙中加入过量双氧水,然后加入碳酸氢铵调节溶液的pH,过滤得到沉淀Al(OH)3、Fe(OH)3,滤液中溶质为MnSO4,
①反应物接触面积越大,反应速率越快;
②在滤液乙中锰元素只以Mn2十的形式存在,且滤渣甲中不含MnO2,则滤渣甲的主要成分是不溶于稀硫酸的二氧化硅;
酸性条件下,二氧化锰和亚铁离子发生氧化还原反应生成锰离子、铁离子和水;
③Fe3+完全沉淀时c(OH-)≥$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L、Al3+完全沉淀时c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L>$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L,铁离子需要的pH较小,铝离子需要的pH较大;如果使这两种两种都完全沉淀,则溶液中c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L=10-9mol/L,据此计算溶液的pH,根据溶度积常数计算此时溶液中Mn2十的浓度;
(3)KMnO4分解时Mn元素得电子、O元素失电子,生成氧气失去电子物质的量等于Mn得到电子的物质的量,生成的锰酸钾、二氧化锰都和浓盐酸反应生成锰离子和氯气,根据转移电子相等知,Mn元素得到电子的物质的量等于生成氯气失去电子的物质的量,则整个反应过程中高锰酸钾中Mn元素得到电子的物质的量等于生成氧气、氯气失去电子的物质的量之和,据此计算生成氯气体积.
解答 解:(1)①MnOOH中O元素化合价为-2价、H元素化合价为+1价,该化学式中各元素化合价的代数和为1确定Mn的化合价为+3;主族元素原子核外电子层数与其周期数相同,最外层电子数与其族序数相等,O原子核外有3个电子层、最外层电子数是6,所以O元素位于第二周期第VIA族,
故答案为:+3;二;VIA;
②设生成MnO2的物质的量为x,
2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2固体质量减少
2mol 56g
x 2.8g
2mol:56g=x:2.8g
x=$\frac{2mol×2.8g}{56g}$=0.1mol,
故答案为:0.1mol;
(2)碳酸锰矿主要成分为MnCO3、MnO2、FeCO3、SiO2、Al2O3,将碳酸锰矿中加入稍过量的稀硫酸,MnCO3、FeCO3、Al2O3和稀硫酸反应分别生成MnSO4、FeSO4、Al2(SO4)3,MnO2氧化性大于Fe3+,则MnO2和Fe2+在酸性条件下发生反应MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,SiO2不反应,过滤后,滤渣成分为SiO2,滤液乙中含有MnSO4、Al2(SO4)3、Fe2(SO4)3,向滤液乙中加入过量双氧水,然后加入碳酸氢铵调节溶液的pH,过滤得到沉淀Al(OH)3、Fe(OH)3,滤液中溶质为MnSO4,
①反应物接触面积越大,反应速率越快,将含杂质的碳酸锰矿使用前需将其粉碎,增大反应物接触面积,反应速率加快,
故答案为:增大接触面积,加快反应速率;
②在滤液乙中锰元素只以Mn2十的形式存在,且滤渣甲中不含MnO2,则滤渣甲的主要成分是不溶于稀硫酸的SiO2;
酸性条件下,二氧化锰和亚铁离子发生氧化还原反应生成锰离子、铁离子和水,离子方程式为MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,
故答案为:SiO2;MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O;
③Fe3+完全沉淀时c(OH-)≥$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L、Al3+完全沉淀时c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L>$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L,铁离子需要的pH较小,铝离子需要的pH较大;如果使这两种两种都完全沉淀,则溶液中c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L=10-9mol/L,溶液的pH=-lg$\frac{1{0}^{-14}}{1{0}^{-9}}$=5,
故答案为:5;
(3)KMnO4分解时Mn元素得电子、O元素失电子,生成氧气失去电子物质的量等于Mn得到电子的物质的量,生成的锰酸钾、二氧化锰都和浓盐酸反应生成锰离子和氯气,根据转移电子相等知,Mn元素得到电子的物质的量等于生成氯气失去电子的物质的量,则整个反应过程中高锰酸钾中Mn元素得到电子的物质的量等于生成氧气、氯气失去电子的物质的量之和,
设生成氯气体积为V2L,根据转移电子守恒得$\frac{{V}_{2}}{22.4}$mol×2+$\frac{{V}_{1}}{22.4}$mol×4=nmol×(7-2)
V=56n-2V1,故答案为:56n-2V1.
点评 本题考查物质制备,为高频考点,侧重考查学生阅读、获取信息、加工利用信息解答问题、计算及知识综合应用能力,明确元素化合物性质、化学反应原理是解本题关键,涉及方程式的计算、溶度积常数计算、化学反应速率影响因素等知识点,难点是溶液pH的计算,注意(3)题转移电子守恒的灵活应用,题目难点中等.


科目:高中化学 来源: 题型:解答题
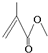 ,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
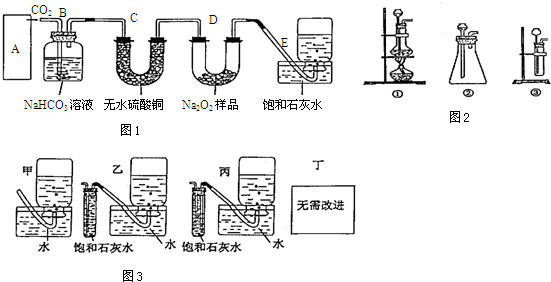
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
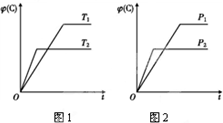 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡后,若使用催化剂,C的体积分数将增大 | |
| B. | 平衡后,若温度升高,化学平衡向正反应方向移动 | |
| C. | 平衡后,增加A的质量化学平衡向正反应方向移动 | |
| D. | 化学方程式中,化学计量数的关系为n<e+f |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HIO3 | B. | HIO2 | C. | HIO | D. | ICl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com